FDA批准全新机制药物治疗干眼症 | 一图读懂:2025年5月下半月全球新药研发进展
创始人
2025-06-05 21:06:00
0次
2025年版第9期《全球药研新动态》
新鲜出炉!

全球新药批准概况
2025年5月下半月,美国食品药品监督管理局(FDA)批准新药申请(NDA)5个,其中包括1个新分子实体(NMEs)。欧洲药品管理局(EMA)批准上市申请(MAA)0个。日本医药品医疗器械综合机构(PMDA)批准新药申请10个,其中包括2个新活性成分药物。
数据来源:Pharma ONE药物研发大数据平台,中国医药工业信息中心
全球药品研发概况
2025年5月下半月,全球进入注册前阶段的新药有5个,其中包括2个新化学实体(NCEs)。
数据来源:Pharma ONE药物研发大数据平台,中国医药工业信息中心
中国药品注册申报概况
2025年5月下半月,国家药品监督管理局药品审评中心(CDE)共受理新注册申请764件(按受理号计,一次性进口申请除外),具体情况如下图。
统计申报临床的药品数量,CDE新受理临床申请申请141件(按受理号计),其中国产药121件、进口药20件。
统计申请上市的药品数量,CDE新受理生产/上市注册申请共209件(按受理号计),其中国产药197件、进口药12件。

数据来源:Pharma ONE药物研发大数据平台,中国医药工业信息中心
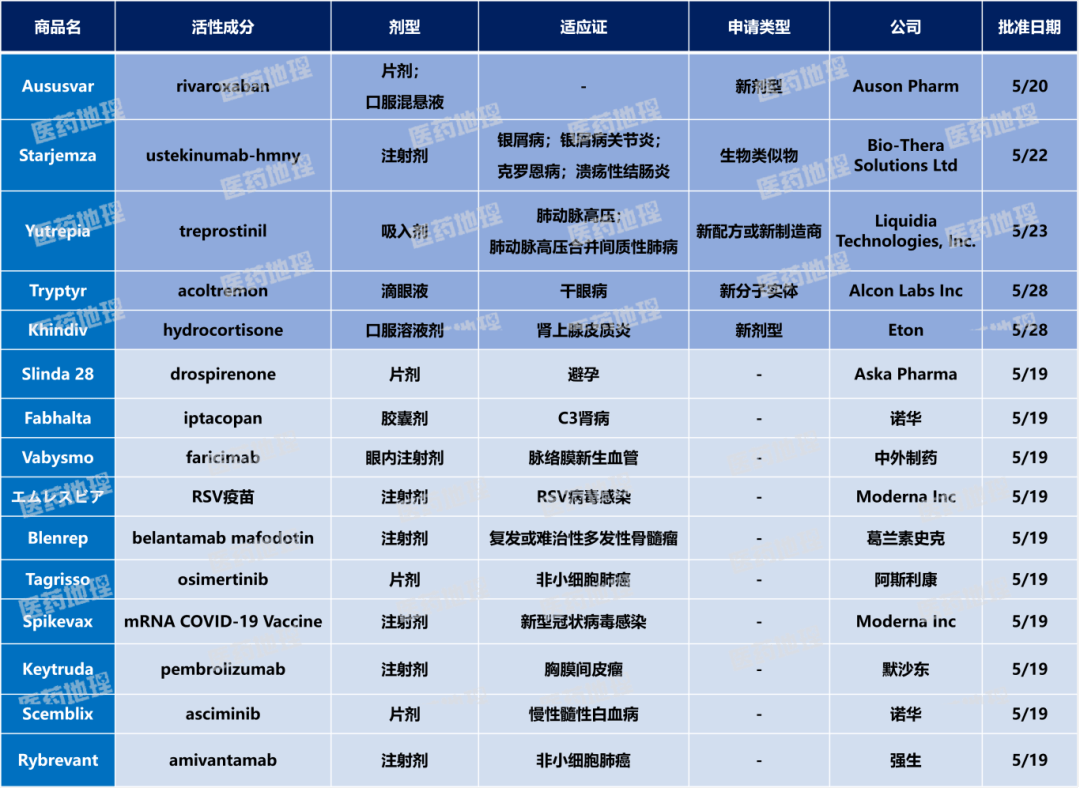
中国药品批准概况
2025年5月下半月,国家药品监督管理局(NMPA)共批准药品上市申请74件。其中,国产药品71件,进口药品3件。
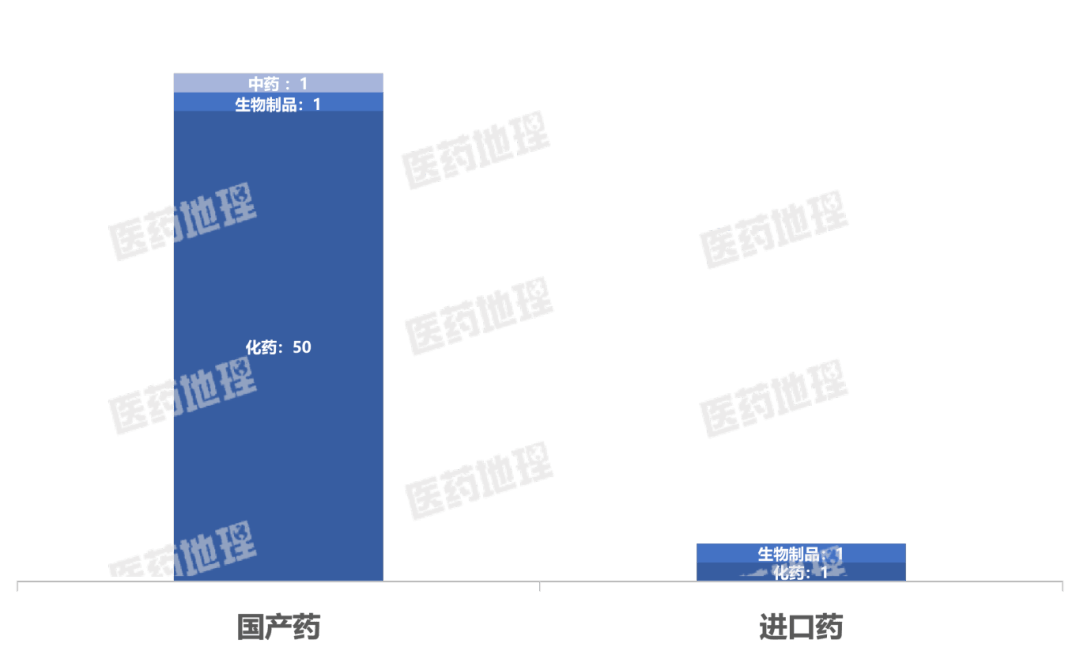
国产药涉及52个品种,其中包括50个化药,1个生物制品,1个中药。
进口药涉及2个品种,其中包括1个化药、1个生物制品。
数据来源:Pharma ONE药物研发大数据平台,中国医药工业信息中心
相关内容
热门资讯
朱传华开展重大项目督导、重点旅...
根据《2025年下半年拼经济、稳增长工作机制》和《三亚市重点旅游景区市级领导包联包保服务工作方案》的...
野趣值拉满!合庆郊野公园焕新归...
想逃离城市纷扰,却不想远途奔波?想深入森林秘境,解锁自然治愈力?市绿化市容局介绍,合庆郊野公园历经数...
“鸥”遇三娘湾 邂逅白海豚
三娘湾拥有“中华白海豚之乡”的美称,这里除了能近距离观看中华白海豚之外,来了还能与海鸥不期而遇。 清...
多项交通便利化举措助力冬季旅游...
央视网消息(新闻联播):随着冬季旅游市场持续升温,全国多地创新服务模式,优化旅游供给,满足游客出行需...
江西南昌鱼尾洲公园:“城市绿洲...
12月19日,江西南昌高新区,鱼尾洲公园内的水杉、落羽杉、池杉等树木层林尽染,与远处的高层建筑相互映...
在长沙想找个安静有设计感的地方...
在长沙想找个安静有设计感的地方待一下午?这5家宝藏书店咖啡馆,本地人私藏! 来长沙旅行,除了打卡橘子...
瞄准海南封关机遇 外国旅行商冀...
中新社海口12月19日电 (张茜翼 黄方舟)“我们将把握海南自贸港封关机遇,持续深耕中国市场,打造更...
旅途风景的追寻:别错过日常,警...
沉浸于旅途之中的风景里,我们到底在追寻着什么呢?并非仅仅只是眼睛所看到的那山川湖海,更是一种身处别的...
如何找到人少景美路线,用手机拍...
旅途中的景致,并非简单只是眼睛所目睹的画面,更是旅程里身心的全面综合体验,它涉及到我们怎样去选择路线...
暴涨45%!预订量已超106万...
距离元旦假期还有十多天 你的跨年计划进行到哪一步了? 一些小伙伴已经把元旦假期 安排得“明明白白”了...
