菟丝子抗衰老活性和作用机制研究进展

衰老是指机体生理功能和体内平衡维持逐渐下降,最终导致生物体死亡的复杂过程[1]。伴随年龄增长,机体会出现形态改变、功能减退及代谢失调现象,导致对外部环境适应性降低,心血管、癌症等发病率大幅增加,寻找能够延缓衰老进程、抑制衰老相关疾病发生发展的药物,对提高人类健康寿命和应对老龄化社会挑战具有重要意义。中医认为,肾气虚损与肾精亏虚是衰老的主要因素之一。因此具有补肾填精、燮理阴阳功效的补益类药物,则被视为具有潜在抗衰老作用的候选药物。菟丝子是来源于旋花科植物南方菟丝子Cuscuta australisR. Br.或菟丝子C. chinensisLam.的干燥成熟种子,味甘性温入肾经[2]。本文系统梳理了以菟丝子为主要药味之一且具有抗衰老作用的经典名方的临床应用实例,进一步根据现代生物学关于衰老相关的分子、细胞和系统上的特征[3],分类梳理菟丝子活性成分延缓衰老的作用和潜在机制;最后系统归纳了菟丝子对衰老相关疾病的治疗作用;为菟丝子抗衰老的临床应用提供参考,也为抗衰老中药的活性研究提供思路和技术支持。
1 含菟丝子的经典名方抗衰老的记载和作用
菟丝子是一种常用的补益药,也是驻景丸、归肾丸、左归丸及八子补肾丸等抗衰老方中主要药味之一[4-7]。近年来,以菟丝子为主要药味复方的抗衰老临床研究报道如下。出自北宋《太平圣惠方》的驻景丸由菟丝子、车前子、熟地黄3味药组成,在治疗肝肾气虚、精血虚损之老年眼病及年龄相关性黄斑变性具有显著功效[8]。一项针对七子育嗣丸(有由菟丝子、枸杞子、五味子、车前子等组成)对35~42岁高龄妇女的体外受精-胚胎移植作用研究显示,治疗组的累计妊娠率及卵母细胞数目均明显提高,提示其具有改善年龄相关女性妊娠能力的作用[9]。针对归肾丸(菟丝子、熟地黄、山茱萸、枸杞子等)治疗卵巢早衰的临床研究显示,连续服药3个月经周期可显著升高患者血清中谷胱甘肽水平,改善氧化应激状态[10]。中药复方加味左归丸(菟丝子、熟地黄、山茱萸、山药等)入肝肾,有报道指出其可以调节肾阴虚证,提高早发性卵巢功能不全患者的血清性激素水平,对潮热盗汗、失眠多梦等围绝经期症状亦有显著改善,提示其具有延缓卵巢早衰的作用[11]。一项针对八子补肾丸(菟丝子、枸杞子、五味子、覆盆子等)治疗早衰疗效和安全性的临床研究显示,服药之后老年人的端粒酶含量显著增加,且步行速度及肌肉质量均得到明显改善[12]。
2 菟丝子抗衰老的生物活性和作用机制
菟丝子的化学成分主要包含黄酮类、酚酸类、木脂素、生物碱类和多糖类等[13-16]。其中,黄酮类化合物不仅种类最为丰富,并且也是当前研究最广泛且深入的组分。主要包括金丝桃苷、槲皮素、芦丁、异槲皮苷、柚皮素、染料木素、木犀草素、芹菜素和山柰酚等41种化合物[13];其次是酚酸类成分,主要有绿原酸、迷迭香酸、异绿原酸B、咖啡酸、对香豆酸和奎宁酸等18种化合物[14]。菟丝中还检测出29种木脂素类化合物,如五味子丙素、橄榄脂素-4'-O-葡萄糖苷、松脂素等[14]。另外,菟丝子还含有甜菜碱、苦参碱及葫芦巴碱等4种生物碱类成分[14]。菟丝子中的多糖成分主要是由半乳糖、葡萄糖、甘露糖、鼠李糖、阿拉伯糖、木糖等单糖聚合而成的中性杂多糖。
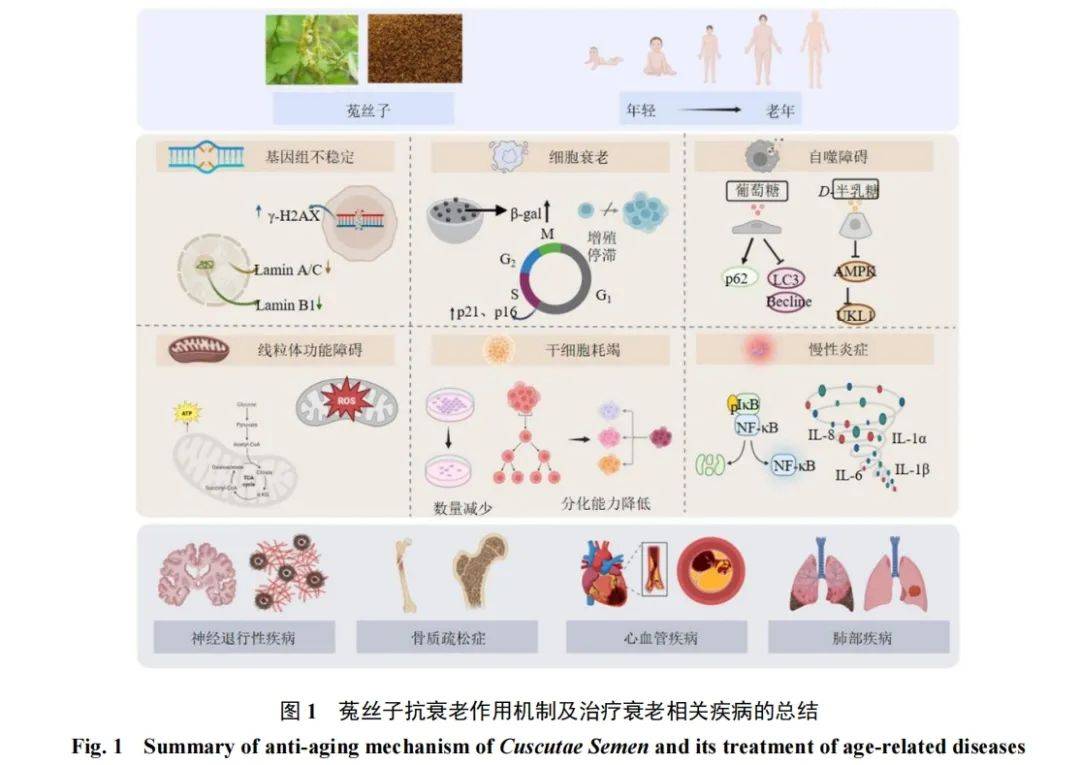
2023年,López-Otín等[3]总结提出了12大衰老特征,即基因组稳定性丧失、端粒损耗、表观遗传改变、蛋白稳态丧失、营养感应失调、线粒体功能障碍、细胞衰老、干细胞耗竭、细胞间通讯改变、巨自噬障碍、慢性炎症和生态失调,并且认为这些特征彼此之间密切相关,共同推动了衰老过程的发展[16]。菟丝子是具有潜在延缓衰老作用的中药,其通过多成分、多靶点发挥抗衰老作用及其机制研究值得关注。
2.1 基因组不稳定性
基因组不稳定性主要是指遗传物质的损伤,如DNA单链或双链的断裂及核结构的改变等。当衰老过程中发生的DNA双链断裂未被修复时,组蛋白H2AX会被磷酸化形成γ-H2AX,是基因组不稳定的标志物之一[17]。此外,核纤层构成了锚定染色质和蛋白质复合体的支架,其缺陷会导致基因组不稳定,其中核纤层蛋白B1(Lamin B1)和Lamin A/C是核纤层蛋白家族的核心成员,参与维持细胞核的结构和功能[3]。
研究发现,在过氧化氢(hydrogen peroxide,H2O2)诱导的衰老骨髓间充质干细胞(bone mesenchymal stem cells,BMSCs)中发现γ-H2AX蛋白表达显著增加,但经槲皮素处理后可以降低γ-H2AX表达[18]。文献报道称梭杆菌会导致牙龈角质形成细胞的衰老,给予槲皮素预处理后有利于增强Lamin B1表达[19]。杨玉田等[20]将BMSCs培养在微重力环境中用于建立细胞衰老模型,通过免疫荧光染色发现槲皮素可以逆转衰老BMSCs中Lamin B1荧光强度降低的现象。Huang等[21]发现小鼠感染弓形虫后会导致其结肠细胞的衰老,在给予达沙替尼和槲皮素治疗后发现结肠组织中Lamin B1蛋白和mRNA表达均上调。
2.2 慢性炎症
慢性炎症是衰老的特征之一,可导致机体免疫功能减弱,无法清除衰老细胞和炎症因子,从而造成炎症和衰老的恶性循环[22]。因此,消除炎症可能是抗衰老的潜在策略。菟丝子中的金丝桃苷、山柰酚、槲皮素和芹菜素等活性成分均被报道具有降低衰老引起的炎症水平升高的作用。
金丝桃苷是菟丝子质量控制的标准成分,研究发现,金丝桃苷可呈剂量相关性降低紫外线B辐射(ultraviolet B radiation,UVB)引起的衰老原代人皮肤成纤维细胞中白细胞介素-6(interleukin-6,IL-6)、IL-8等促炎因子的分泌[23]。类似地,在采用UVB直接辐射诱导和通过人角质形成衰老细胞HaCaT的条件培养液间接诱导2种方法建立的人包皮成纤维Hs68细胞衰老模型中,给予槲皮素或山柰酚可以抑制炎症相关因子核因子-κB(nuclear factor-κB,NF-κB)通路的磷酸化激活[24]及基质金属蛋白酶1(matrix metalloproteinase 1,MMP1)的分泌[25]。在衰老小鼠的神经炎症方面,槲皮素不仅可以改善小鼠大脑海马中NOD样受体热蛋白结构域3(NOD like receptor family pyrin domain containing 3,NLRP3)、凋亡相关斑点样蛋白(apoptosis-associated speck-like protein containing a CARD,ASC)炎症蛋白的表达[26],还可减轻海马锥体层细胞IL-1α的水平,提示其具有抑制年龄相关的脑部炎症的作用[27]。在博来霉素诱导的衰老人包皮成纤维BJ细胞中,山柰酚和芹菜素可以显著抑制细胞因子IL-1α、IL-1β、IL-6和IL-8的表达[28]。ig芹菜素还可显著降低21月龄老年大鼠肾脏中IL-6、趋化因子配体1(C-X-C motif chemokine ligand 1,CXCL1)、IL-1α、IL-1β的表达,其机制与NF-κB通路有关[28]。
2.3 细胞衰老
细胞衰老是一种永久性的停滞状态,具体表现有细胞周期阻滞及不可逆的增殖停滞等。衰老的细胞随年龄增长在体内积累,与多种疾病的致病部位共定位。缓解细胞周期阻滞,对增殖停滞的衰老细胞进行清除成为抗衰老药物的重要作用方式。
在细胞周期调控方面,p21、p16和cyclin家族均参与了细胞周期调控过程,其中p21和p16主要负责阻止细胞从G1期向S期过渡,cyclin的周期蛋白则是驱动细胞从G1期进入S期[29];在细胞周期进程中ki-67的表达起始于G1期并在S期逐渐上升[30]。在衰老过程中,p21、p16表达显著升高,cyclin的周期蛋白和ki-67表达下降。研究发现,菟丝子醇提物可降低D-半乳糖(D-galactose,D-gal)诱导的衰老大鼠肝细胞中p21的表达,促进cyclin E的表达延缓肝脏衰老[31]。在菟丝子的活性成分方面,金丝桃苷可以下调PM2.5诱导的衰老HaCaT细胞中p21和p16表达,改善细胞周期停滞[32]。山柰酚也可以上调阿霉素和胰岛素样生长因子-1(insulin-like growth factor-1,IGF-1)联合诱导的衰老人真皮成纤维细胞增殖和分化标记物ki-67表达[33]。
在衰老细胞清除方面,菟丝子中的活性成分槲皮素是选择性消除衰老细胞策略(senolytics)的候选药物之一,此外金丝桃苷、山柰酚、咖啡酸、芦丁等活性成分也可以降低衰老细胞带来的多种有害影响。基于体外筛选senolytics发现槲皮素可以显著降低辐射诱导的人脐静脉内皮HUVEC细胞活力,随后体内实验发现槲皮素可以以时间依赖性减少衰老、辐射暴露和早衰样Ercc1基因缺失(Ercc1−/Δ)小鼠的衰老细胞负荷,增强老年小鼠的心脏和血管功能,减少局部照射引起的功能障碍,减轻早衰小鼠的骨骼和神经表型[34]。此外,槲皮素还可以通过减少博来霉素诱导的肺泡上皮RLE-6TN衰老细胞的数量和降低衰老相关β半乳糖苷酶(senescence-associated β-galactosidase,SA-β-gal)活性来阻碍肺纤维化(pulmonary fibrosis,PF)的进展[35]。另外,Liu等[36]报道指出芦丁能够下调由博来霉素诱导的衰老正常人前列腺基质PSC27细胞中衰老相关分泌表型(senescence-associated secretory phenotype,SASP)的表达,从而抑制衰老细胞的促肿瘤活性。芹菜素和山柰酚亦可以通过消除口腔黏膜纤维化(oral submucous fibrosis,OSF)区域衰老的肌成纤维细胞降低OSF发生癌变的风险[37]。Cho等[38]发现槲皮素可以显著减少20月龄老年小鼠肺脏p16阳性的细胞数量从而达到延缓肺脏衰老的作用。
2.4 线粒体功能障碍
线粒体是细胞的能量工厂,也是活性氧的主要来源及三磷酸腺苷(adenosine triphosphate,ATP)生成的核心场所[39]。当线粒体功能发生障碍时,会导致活性氧过度积累及ATP合成减少[40]。研究发现老年男性红细胞中线粒体DNA异常增加时,丙二醛水平显著上升,同时伴随超氧化物歧化酶(superoxide dismutase,SOD)活性下降,说明氧化损伤与线粒体功能直接相关[41]。此外,随着年龄增长,当线粒体DNA发生突变积累、线粒体动力学变化等功能异常也会加速衰老[3]。近年来,研究报道证实菟丝子及其活性成分槲皮素可以通过修复氧化损伤、降低氧化应激水平、提高ATP产生,激活腺苷酸活化蛋白激酶(adenosine monophosphate activated protein kinase,AMPK)/过氧化物酶体增殖物激活受体γ共激活因子-1α(peroxisome proliferator-activated receptor γ coactivator-1α,PGC-1α)信号通路而改善线粒体功能。
刘海云等[42]研究发现,菟丝子提取物可以显著升高12~14月龄自然衰老小鼠肝和脑组织中ATP酶活力和过氧化氢酶(catalase,CAT)活性。菟丝子水提物可以延缓D-gal诱导的小鼠衰老进程,其作用与提高SOD活力、降低丙二醛含量有关[43]。此外,在自然衰老模型小鼠中,菟丝子多糖较枸杞多糖和熟地黄多糖更显著提升10月龄早衰雌鼠血清中的SOD水平并降低丙二醛含量,从而延缓卵巢功能衰退[44]。芦丁还可增强D-gal诱导大鼠肝脏和大脑组织中抗氧化标志物SOD、谷胱甘肽过氧化物酶1(glutathione peroxidase 1,GPX1)和谷胱甘肽S-转移酶-α活性[45]。
在菟丝子的主要活性成分研究方面,报道指出槲皮素可减轻与年龄相关的线粒体氧化应激及改善线粒体功能障碍。在秀丽隐杆线虫的液体培养基中加入槲皮素可以增强其对氧化应激的抵抗力,预防线粒体功能障碍,促进线虫的平均存活时间[46]。研究发现槲皮素可以显著增强血管紧张素II(angiotensin II,Ang II)诱导的衰老大鼠肾近端肾小管上皮NRK-52E细胞中的线粒体膜电位、增加线粒体质量及保护线粒体形态[47]。在10月龄抗肌萎缩蛋白基因敲除的Mdx/Utrn+/−老年小鼠模型中,槲皮素通过激活PGC-1α通路增加线粒体蛋白质含量有效改善了心脏功能[48]。山柰酚的抗氧化和抗衰老活性在模式生物秀丽隐杆线虫中得到证实,其可以减少线虫在热应激下的活性氧及衰老标志物脂褐素的积累,延长线虫的寿命[49]。体外培养10月龄的自然衰老小鼠卵母细胞,给药槲皮素可以增加其线粒体沉默信息调节因子2(sirtuin 2,SIRT2)相关蛋白SIRT3介导的SOD2乙酰化水平,降低活性氧水平,改善卵母细胞的质量[50]。Choi等[51]在H2O2诱导的衰老人真皮成纤维细胞(human dermal fibroblasts,HDFs)中发现,给药芦丁可以显著降低细胞内的活性氧水平。在紫外线诱导BJ及HDFs衰老细胞模型中,通过流式细胞术检测活性氧水平,发现用绿原酸处理可降低衰老BJ及HDFs中的活性氧水平[52-53],以上研究表明芦丁和绿原酸在皮肤光老化过程中具有保护作用。
2.5干细胞耗竭
干细胞是一类具有自我更新、组织修复和多向分化潜力的细胞类型[54],在衰老过程中干细胞的数量逐渐减少,功能明显下降[55]。一些研究探索了菟丝子的生物活性化合物对干细胞的影响发现,芦丁可以以剂量相关性的方式抑制H2O2诱导老年大鼠间充质干细胞(mesenchymal stem cells,MSCs)的老化,提高其在体内的再生效率[56]。槲皮素也可以抑制早衰Ercc1−/Δ小鼠骨髓来源的衰老间充质干细胞数量的增加[34]。
2.6自噬功能障碍
自噬作为一种细胞代谢过程,可以通过溶酶体消除和降解受损的核酸、错误折叠的蛋白质聚集体以及异常脂质和细胞器。研究表明,自噬在衰老过程中扮演着双重角色。一方面,衰老过程伴随自噬功能受损,因此适度激活自噬可以减少有毒蛋白质积累,改善线粒体功能及减少不必要的细胞死亡,从而延缓衰老。另一方面,过度自噬亦可能导致细胞功能代谢紊乱甚至缩短寿命[57]。寻找能够在衰老过程中维持自噬平衡的候选药物至关重要。
有报道发现,在卵泡发育障碍的大鼠模型中,含有菟丝子的“苁蓉菟丝子丸”可下调自噬相关分子溶酶体相关膜蛋白2(lysosomal-associated membrane protein 2,LAMP2)、组织蛋白酶D的表达促进卵泡发育,修复受损的卵巢功能,为临床应用此方治疗卵巢早衰、早发性卵巢功能不全等卵巢功能低下类疾病提供科学依据[58]。Liu等[59]发现金丝桃苷可以抑制D-gal诱导的衰老NRK-52E细胞中衰老和肾损伤,其机制与抑制AMPK-Unc-51样自噬激活激酶1(Unc-51 like autophagy activating kinase 1,ULK1)介导的自噬相关。此外研究还发现自然衰老小鼠ig芦丁后可以通过增强肝细胞的自噬活性延长其健康寿命[60]。研究表明,槲皮素通过靶向自噬通路发挥抗衰老作用:在Ang II诱导的衰老NRK-52E细胞中可以通过激活SIRT1/PTEN诱导假定激酶1(PTEN-induced putative kinase 1,PINK1)/帕金森蛋白RBR E3泛素连接酶(Parkin RBR E3 ubiquitin-protein ligase,Parkin)通路增强线粒体自噬,从而缓解衰老[47];在氧化低密度脂蛋白(oxidized low-density lipoprotein,ox-LDL)刺激的RAW264.7细胞中则通过增加自噬体生成从而抑制泡沫化进程并延缓细胞衰老[61]。
2.7其他
研究发现随着年龄的增长,通常会伴随端粒长度缩短及端粒酶活性下降的现象。所以延长端粒长度或控制端粒酶的激活被认为是延缓衰老的一种机制[62]。在衰老过程中,表观遗传学变化的机制包括DNA甲基化模式的改变,组蛋白翻译后修饰异常,异常染色质的重塑及非编码RNA的功能失调等,研究发现通过改善DNA甲基化水平、过表达异染色质蛋白1α及激活组蛋白去乙酰化酶活性均可延长寿命[63-65]。研究认为导致蛋白质稳态崩解的机制与蛋白质错误翻译、错误折叠或不完整蛋白质的产生增多有关。若通过增强蛋白酶体活性以及减少内质网压力则有利于改善蛋白质稳态并延长寿命[66-67]。营养感知通路IGF-1、哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)等在衰老过程中发挥重要作用。研究发现,在成年或成年后期抑制生长激素(growth hormone,GH)/IGF-1通路可以延长小鼠等模式生物的寿命[68]。衰老与细胞间通讯的进行性改变相关,损害了稳态和激素调节。研究发现通过对老年小鼠注射抗炎因子IL-37可以提高运动耐力[69]。报道称人类在衰老过程中,菌群的结构和活性会逐渐发生变化,最终导致其多样性下降。在对百岁老人进行的研究表明,健康衰老的微生物群模式特征是拟杆菌等核心菌群的耗竭[70]。此外,特定的胆汁酸代谢也有助于维持肠道内稳态,从而降低年龄相关慢性疾病的易感性[71]。
综上,菟丝子及其化学成分延缓衰老的作用机制仅涉及上述经典12大衰老标志物中的部分环节,在延长端粒长度、改善表观遗传状态、恢复蛋白质稳态、调节营养感应网络、改善细胞间通讯及肠道生态的平衡发挥等方面,尚未发现菟丝子的抗衰老研究报道。
3 菟丝子改善衰老相关性疾病的发展
衰老是一个渐进、不可逆的生理过程,随着衰老的加剧,多种衰老相关疾病如神经退行性疾病、肌肉骨骼疾病、心血管疾病(cardiovascular disease,CVDs)和肺部疾病等患病风险均显著增加,成为影响老年人健康和寿命的重要病因[72]。大量研究证实菟丝子及其活性成分可以抑制衰老相关疾病的发生发展。
3.1神经退行性疾病
衰老是以阿尔茨海默病(Alzheimer’s disease,AD)为代表的神经退行性疾病发展的重要危险因素之一[73-74]。报道指出,菟丝子中的槲皮素、咖啡酸、绿原酸和芹菜素等活性成分对AD的进展具有显著的抑制作用。
李琳[75]发现槲皮素可以诱导具有AD表型的7月龄SAMP8小鼠大脑组织海马区中SIRT1/过氧化物酶体增殖物激活受体γ(peroxisome proliferator-activated receptor γ,PPARγ)的激活,缓解内质网应激,表现出神经保护和抗衰老作用。Sabogal-Guáqueta等[76]发现连续给药槲皮素可以减少21~24月龄转基因3xTg-AD小鼠的星形胶质细胞和小胶质细胞增生,逆转AD的组织学病变,保护小鼠的认知和情绪功能。在由膳食晚期糖基化产物(dietary advanced glycation end-products,dAGEs)诱导的15月龄老年认知障碍小鼠模型中,添加槲皮素的饲料可增加小鼠大脑海马区微小核糖核酸-219(micro RNA-219,miR-219)、miR-15a和miR-132的表达,抑制细胞外信号调节激酶1/2(extracellular signal-regulated kinase 1/2,ERK1/2)和微管相关蛋白tau的磷酸化,改善老年小鼠的认知障碍[77]。对菟丝子活性成分咖啡酸抗AD的研究发现,咖啡酸可以通过促进海马体神经新生减轻D-gal诱导衰老大鼠的记忆损伤和海马神经缺陷[78];还可减轻秀丽隐杆线虫AD模型中由淀粉样β肽(amyloid-β peptide,Aβ)诱导的毒性,延长线虫寿命、改善生殖缺陷[79]。此外,有报道指出绿原酸可以减轻异氟醚诱导的20月龄老年小鼠的认知障碍[80];芹菜素可以通过抑制神经炎症改善25月龄的老年小鼠认知功能障碍[81];紫云英苷可以减轻AlCl3和D-gal联合诱导的小鼠衰老样表型和认知障碍,其作用机制与抑制大脑中氧化应激和神经炎症水平有关[82]。
3.2 骨质疏松症
衰老对骨骼系统的影响主要表现为骨量的增龄性丢失、骨骼肌老化及肌肉萎缩等现象,严重者甚至出现老年性骨质疏松症[83]。中医认为,骨质疏松症的发病机制与肾主骨生髓理论紧密相连,补肾填精是其治疗的核心[84]。菟丝子对骨衰老相关的疾病的治疗作用亦有研究和报道。
研究发现,槲皮素可以有效清除阿霉素诱导的衰老小鼠骨髓中的衰老BMSCs,并通过恢复其成骨功能促进老年小鼠的骨形成能力[85];对连续传代诱导的人衰老骨髓间充质基质细胞(bone marrow mesenchymal stromal cells,BM-MSCs)产生的炎症介质单核细胞趋化蛋白-1(monocyte chemoattractant protein-1,MCP-1)、IL-1β也有明显的抑制作用[86];还可显著增强老年MSCs向成骨细胞和软骨细胞分化的能力[87]。芹菜素可以改善16月龄小鼠的肌肉萎缩现象,其机制与减少氧化应激和抑制过度活跃的自噬有关[88]。山柰酚可以改善连续传代诱导的原代老年小鼠成肌细胞衰老表型,维持骨骼肌正常活性氧和氮物质信号传导[89]。
3.3 CVDs
CVDs患病率与人口老龄化关系密切[90],预计到2030年全球约1/5的人口将达到65岁或以上,而CVDs将导致这个年龄段40%的死亡病例,并成为首要死因[91]。与衰老相关的心血管疾病主要包括心力衰竭、动脉粥样硬化、心肌纤维化、心肌梗死等,具体的病理表现则包括心脏收缩力下降、舒张功能受损、钙化、内皮功能障碍、血管松弛缺陷及血管衰老等环节[92]。菟丝子的多个活性成分如绿原酸、槲皮素和芦丁均可以改善CVDs相关症状和病理环节。
一项针对中老年人的临床调查发现,绿原酸和槲皮素均具有改善心肌和内皮功能、降低冠心病和高血压患病风险的潜在能力[93]。实验研究方面,Li等[94]发现绿原酸可以减少10月龄SAMP8老年小鼠心脏缺血再灌注(ischemia/reperfusion,I/R)手术诱导的心肌梗死(myocardial infarction,MI),其作用机制与减少线粒体活性氧、调节丝裂原活化蛋白激酶磷酸酶-1(mitogen-activated protein kinase phosphatase-1,MKP-1)/c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)信号和改善炎症反应有关。对(14±3)月龄的C57/BL6J雌性小鼠sc Ang II诱导血管衰老,ig绿原酸可以通过核因子E2相关因子2(nuclear factor E2 related factor 2,Nrf2)/血红素加氧酶-1(heme oxygenase-1,HO-1)通路延缓内皮衰老,减少心血管疾病的发生[95]。Geng等[96]证实槲皮素可以提高14个月大的衰老C57BL/6J雄性小鼠心脏二尖瓣峰早期至晚期舒张充盈速度比值频率。用槲皮素干预H2O2诱导的大鼠心肌H9C2衰老细胞,可以抑制线粒体渗透过渡孔的开放,缓解线粒体的氧化应激反应[97];槲皮素还可以延缓ox-LDL诱导的人主动脉内皮HAECs细胞衰老,同时转录组数据提示其作用机制与调控CDKN2A、EIF4E1B和IGFBP3的表达有关[98]。另外,芦丁可以通过抑制氧化应激和保护端粒延缓H2O2诱导的原代血管平滑肌VSMCs细胞过早的衰老[99]。
3.4 肺部疾病
衰老是慢性阻塞性肺病、PF、哮喘、肺炎和急性呼吸窘迫综合征等急慢性肺病的主要危险因素[100-101]。在衰老过程中,肺部出现肺泡壁增厚、肺泡数量减少、肺泡腔扩大及肺部弹性回缩力下降等结构和功能的变化,导致个体对肺部疾病的易感性增加[102]。研究发现菟丝子的活性成分槲皮素和咖啡酸可以对与衰老相关的肺部疾病有明显抑制作用。
Hohmann等[103]发现槲皮素可以降低气管滴注博来霉素诱导的12月龄小鼠PF模型的致死率,还可以逆转老年小鼠肺衰老标志物p21和p19-ARF的表达。用博来霉素刺激鼠II型肺泡上皮RLE-6TN细胞构建肺泡上皮细胞衰老模型,槲皮素预处理可以减少衰老上皮细胞诱导的成纤维细胞胶原蛋白的沉积[35]。体外培养衰老的肺成纤维细胞,用咖啡酸处理可以减少SASP和胶原蛋白的产生[104]。
4结语与展望
菟丝子作为传统抗衰老药材,现代研究表明其不仅具有延缓机体衰老进程的作用,对衰老相关的疾病(如AD、骨质疏松症、CVDs、肺部疾病等)也展现出显著的干预效果(图1)。其机制涉及保护基因组稳定性、减轻慢性炎症、延缓细胞衰老或清除衰老细胞、改善线粒体功能障碍、提高干细胞修复和再生能力及维持自噬平衡。然而当前研究仍存在部分局限性:首先,现有研究多聚焦于单一活性成分对特定信号通路的调控,缺乏对菟丝子全成分组及其协同作用网络的系统解析;其次,实验模型多采用单一衰老标志物检测体系,未能构建涵盖基因组损伤、线粒体功能障碍、慢性炎症等复合衰老特征的整合性评价系统;再者,现有研究多基于细胞实验或短期动物模型,因此,在基于临床病程特征构建的衰老-疾病叠加模型中,菟丝子的作用机制研究仍存在较大探索空间。
针对上述研究限制,可以从以下3个角度推进研究:(1)在基础研究层面,可运用多组学联用技术(代谢组学-蛋白质组学-表观基因组学)系统解析菟丝子化学成分谱与衰老相关生物标志物的动态关联,结合网络药理学和分子对接技术构建“成分-靶点-通路”多维互作网络;(2)在机制研究层面,可选用秀丽隐杆线虫、酿酒酵母、果蝇等经典模式生物,同时借助探针标记、高通量筛选、CRISPR/Cas9文库筛选和机器学习等技术,探究菟丝子对衰老微环境的作用机制;(3)开展针对菟丝子的大样本、多中心的抗衰老活性临床试验,采用综合性衰老评估体系(包括表观遗传时钟、炎症因子谱、代谢组特征等新型生物标志物),建立药效-成分-剂量-疗程的量化关系模型,为菟丝子抗衰老及改善衰老相关疾病提供更多更直接的数据和临床证据,更能为开发抗衰老中药提供科学依据。
上一篇:水上乐园的尽头,是医院妇科
下一篇:侯老师视频怎么样
