复发和转移哪一个严重,癌症预防复发转移,从监测到治疗步步为营,找对方法让肿瘤变慢病
复发和转移哪一个严重,癌症预防复发转移,从监测到治疗步步为营,找对方法让肿瘤变慢病
对癌症患者而言,治疗后的每一次复查都像是一场“考验”,而“复发”和“转移”都是癌症治疗后最令人担忧的情况,更是让无数患者揪心的“雷区”。它们不仅直接关系到治疗效果,更会显著影响患者的生存质量和五年生存率。那么,癌症复发和转移到底哪个更可怕?患者又该如何主动预防?这篇文章将为您逐一解答。
癌症复发和转移的本质区别
癌症的核心特征是癌细胞的失控增殖和扩散能力,复发和转移均源于此,要比较两者的危害,首先要明确它们的本质区别。
1、癌症复发:是指癌症经过治疗(如手术、放疗、化疗等),在原发部位或邻近组织再次出现癌细胞,形成新的肿瘤,复发的癌细胞通常与原发肿瘤的病理类型一致。比如肺癌在肺部原发处复发、乳腺癌在乳腺区域复发,且未扩散到远处器官。
2、癌症转移:是指癌细胞脱离原发肿瘤,通过血液、淋巴系统等途径扩散到身体其他远处器官,并在新部位形成继发肿瘤(称为“转移灶”)。转移的癌细胞是原发肿瘤的“扩散版”,侵袭性和生存能力更强。比如肺癌转移到脑、骨;乳腺癌转移到肝、肺,在新部位形成继发肿瘤。
为什么说转移通常比复发更可怕
转移意味着癌细胞已进入"全身扩散阶段",恶性程度更高、侵袭性更强
1、局部复发(非远处复发):复发的癌细胞虽属于“残留”病灶,但尚未突破局部屏障,未发生远处扩散,仍局限在原发部位或邻近区域,说明其侵袭性相对较弱(或尚未获得转移能力)。
2、癌症转移:转移的本质是癌细胞突破原发部位的“束缚”,通过血液或淋巴系统扩散至远处器官,属于全身性疾病状态。这一过程需经历癌细胞突破基底膜、进入循环系统、躲避免疫系统攻击、在新器官“扎根生长”等一系列复杂步骤,能完成转移的癌细胞通常基因更不稳定、恶性程度更高、对治疗的耐药性也更强。
转移的预后更差,五年生存率显著更低
五年生存率是评估癌症预后的核心指标,而转移和复发对生存率的影响差异显著,这也是转移成为癌症死亡主要原因的关键所在。
1、局部复发的生存率相对可控:若能早期发现并积极治疗,局部复发对五年生存率的影响有限。对于无转移的早期癌症,若手术彻底切除,五年生存率可高达70%-90%(如早期胃癌、乳腺癌);即便发生局部复发,经规范治疗后部分患者仍能达到较好效果,例如直肠癌局部复发后通过放化疗+手术,或胃癌术后局部复发接受二次手术+化疗,五年生存率可达20%-50%以上,显著高于转移病例。
2、远处转移的生存率大幅下降:一旦发生远处转移,癌症多进入晚期,五年生存率会明显降低,多数癌症的五年生存率降至10%-30%以下,部分恶性程度高的癌症(如胰腺癌、晚期肝癌)甚至不足5%。
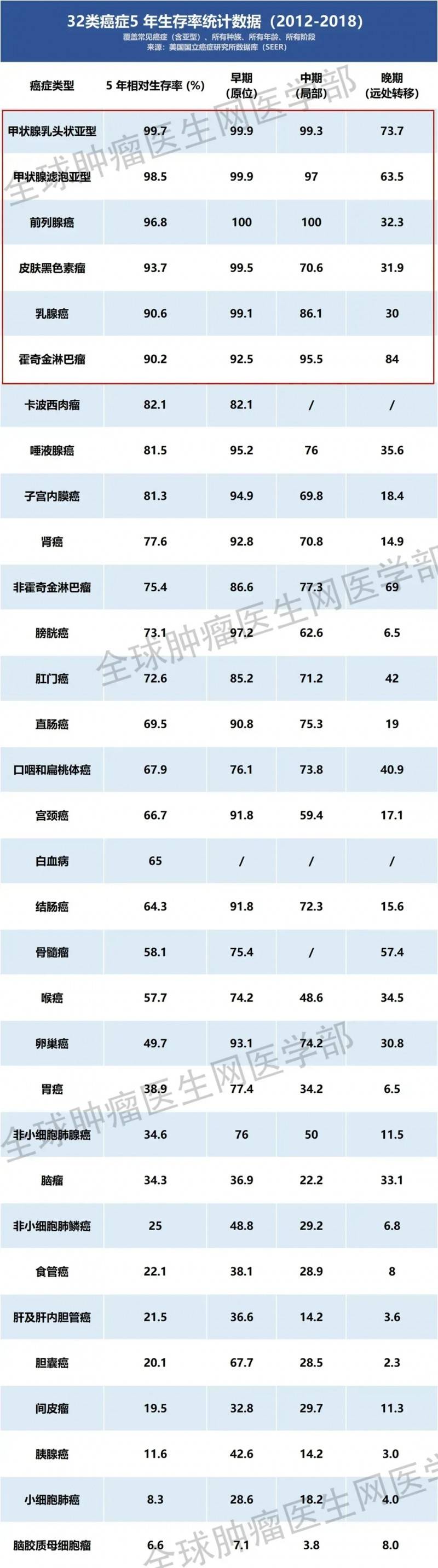
▼32类常见癌症的5年生存率
转移的症状更复杂,患者生活质量更差
1、复发多局限于原发部位,症状相对单一(如局部肿块、疼痛)。
2、转移的症状因受累器官不同呈现多样性和复杂性,具体表现由转移灶位置决定:骨转移会导致剧烈骨痛、病理性骨折;肺转移会引起咳嗽、咯血、呼吸困难;肝转移会导致黄疸、腹水、肝区剧痛;脑转移会引发头痛、呕吐、癫痫、甚至昏迷。这些症状不仅严重降低患者的生活质量,还会加速身体机能的衰竭,进一步削弱患者对治疗的耐受性。
转移的进展速度更快,更易引发多器官衰竭
1、局部复发若未发生扩散,病情进展相对缓慢,对全身器官的影响较小,短期内不会直接危及生命。
2、而转移的癌细胞本身具有更强的侵袭性和耐药性(经过原发灶治疗筛选后,存活的癌细胞恶性程度更高),且转移灶往往呈现多发特性、还可分布于不同器官,这些转移灶会“掠夺”全身营养、破坏器官功能,甚至危及生命,例如肝转移导致肝功能衰竭、肺转移引发呼吸衰竭等。
转移的治疗难度远大于复发,呈指数级上升
从总体趋势来看,转移的治疗难度远大于局部复发。
1、复发的治疗:局部复发若未扩散,癌细胞仍局限于原发部位或邻近区域,治疗多以“局部控制”为主。若如果是早期局部复发(复发范围较小、未侵犯重要器官),通过二次手术、局部放疗、消融或靶向治疗等手段,往往可再次清除病灶,甚至仍有根治机会,例如早期乳腺癌局部复发后,经手术切除+辅助治疗,5年生存率仍可达50%-70%。肺癌局部复发也可通过二次手术或立体定向放疗有效控制。
2、转移的治疗则面临更大挑战:转移意味着癌细胞已扩散到远处器官(如肝、肺、脑、骨等),此时局部治疗(手术、放疗)难以覆盖所有转移灶,需依赖全身治疗(化疗、靶向治疗、免疫治疗等)。但远处转移灶的癌细胞往往已积累更多基因突变,对药物的耐药性更强,且不同转移灶可能存在“异质性”(即不同部位的癌细胞对治疗的反应不同),导致治疗方案难以统一,很多时候治疗目标只能是“延长生存”而非“治愈”。比如晚期肺癌一旦转移到脑,即便应用靶向药或放疗,也很难彻底清除所有脑转移灶,且脑转移可能快速进展导致昏迷、偏瘫。
特殊情况:并非所有转移都比复发可怕
不过需要强调的是,“转移更可怕”是总体趋势,存在个体差异:
1、部分“寡转移”(转移灶数量少、局限于1-2个器官)患者,通过精准放疗(如立体定向放疗)或手术切除转移灶可能获得长期生存,例如结直肠癌肝寡转移患者经手术切除肝转移灶联合化疗,5年生存率可达30%-50%。
2、另有部分晚期复发(如原发肿瘤治疗多年后复发且伴随转移)的危害可能与转移相当,例如乳腺癌术后10年复发合并肺转移,其预后与初诊肺转移类似。
癌症康复期必修课:从日常调理到前沿治疗,这些手段全方位阻断复发与转移
对患者来说,与其纠结哪个更可怕,不如积极预防。无论是复发还是转移,早期发现(如定期复查肿瘤标志物、影像检查)都是改善预后的关键。例如局部复发若能在早期(肿瘤较小时)干预,治疗效果远好于晚期;转移若能在“寡转移”(转移灶数量少、局限)阶段处理,部分患者仍可获得长期生存。对患者而言,更重要的是通过以下方式降低复发/转移风险。
筑牢基础防线:日常管理是预防的"第一道屏障"
很多患者在治疗结束后急于回归正常生活,却忽略了身体仍处于“免疫脆弱期”。此时癌细胞可能以“微小残留病灶”的形式潜伏,日常管理的质量直接决定免疫系统能否有效“监视”,并清除隐患。
1、适当运动,激活免疫“巡逻队”:长期卧床或久坐会导致免疫力下降,而适度运动能让免疫细胞“动起来”。术后患者应根据身体状况选择散步、慢跑等运动,以促进血液循环和心肺功能恢复。但运动需循序渐进、避免过度劳累:治疗初期可从每天10分钟散步开始,逐步增加至30分钟,以身体不感到疲惫为宜。
2、心理调节,别让压力“瓦解”免疫力:焦虑、抑郁等负面情绪会通过神经-内分泌系统抑制免疫功能,这也是临床中“心态差的患者更易复发”的重要原因。患者可通过冥想、正念训练、加入康复互助小组等方式调节情绪,家人的陪伴与理解同样关键,轻松的家庭氛围能帮助患者保持积极心态,为免疫系统“减压”。必要时可寻求心理医生帮助,以缓解压力。
3、改善生活方式,筑牢免疫防线:戒烟戒酒、均衡饮食、坚持适度运动及控制体重等健康习惯,能从整体上增强免疫力,降低癌细胞“卷土重来”的概率。
营养支持:给免疫系统"充电"
肿瘤本身及治疗过程会大量消耗身体能量,康复期的营养补充并非“大补特补”,而是通过精准供给免疫细胞所需的“战备物资”,助力患者提升免疫功能、增强抗癌治疗耐受性、改善整体健康状况。
1、保持营养均衡
蛋白质是免疫细胞的合成原料,需每日保证鱼、蛋、奶、豆制品等优质蛋白的摄入;维生素C(新鲜果蔬)、锌(坚果、贝类)、硒(蘑菇、谷物)等微量元素能增强免疫细胞活性;Omega-3脂肪酸(深海鱼、亚麻籽)可减轻慢性炎症,避免为癌细胞提供适宜生存环境。同时需避免高糖、高脂饮食,这类食物会抑制免疫细胞功能,甚至加速癌细胞增殖。
2、补充特定的营养素
部分特定营养素不仅能提供能量和营养底物,还可刺激免疫细胞活性、维持肠道屏障功能、增强免疫应答能力,有助于改善癌症患者的临床结局。
1)益生菌:作为“活的非病原性微生物”,适量补充可提高机体免疫功能,对改善肺癌、肝癌、结直肠癌、肾癌等癌种的预后具有积极作用,同时有助于降低放化疗副作用,提升患者生活质量。
2)益生元:这类不被宿主消化吸收但能被肠道有益菌分解的有机物(如双歧因子、人参多糖、膳食纤维等),可促进益生菌生长繁殖,调节肠道菌群代谢向利于抗癌治疗的方向转变,从而提高癌症免疫治疗效果。
3)胸腺肽:胸腺肽是从胸腺提取的活性多肽(如胸腺五肽、胸腺素α-1)。2023年ASCO大会公布的临床研究显示,胸腺素α-1治疗可改善晚期或难治性实体瘤患者的生存结局,显著增加外周淋巴细胞亚群数量,患者中位总生存期(OS)达19.6个月(95%CI:6.6~27.2)。
4)人参皂苷:以人参皂苷Rh2为例,其可通过多种途径调节并增强机体免疫功能,包括提高巨噬细胞吞噬功能、NK细胞杀伤活性及IL-2(白介素-2)活性,进而发挥抗肿瘤功效。
肿瘤患者的营养状况、个体情况、癌种、分期及治疗方式存在差异,具体饮食调理方案需个性化制定。建议患者在保证均衡营养、健康饮食的基础上,避免盲目大量服用膳食补充剂,以防延误病情或引发不良后果。如需进一步指导,可通过医学部,咨询权威的营养专家。
医学监测:抓住复发转移的"早期信号"
1、常规检查必不可少
治疗结束后,定期复查至关重要,术后或治疗后要定期通过CT、MRI、肿瘤标志物检测等,早期发现复发或转移,为治疗争取时间。
2、三种特殊检测:捕捉"隐形杀手"
对高危患者(如晚期癌症治疗后、存在高危基因突变),ctDNA检测、MRD检测、CTC检测等,能更早发现复发风险,为干预提供关键依据。
1)液体活检技术(ctDNA检测):ctDNA是癌细胞死亡后释放到血液中的微量DNA片段,治疗后若ctDNA持续阳性或浓度升高,提示体内可能存在微小残留病灶,需及时调整干预方案。临床数据显示,ctDNA检测可比传统影像学提前3-6个月发现复发迹象,为阻断病情进展争取更充足的时间。
2)循环肿瘤细胞(CTC)检测:CTC源自原发肿瘤或转移灶,是进入外周血液循环的恶性肿瘤细胞。通过检测血液中的CTC,可评估肿瘤的存在、进展情况及治疗效果,为肿瘤精准诊断与治疗提供重要参考。
3)微小残留病灶(MRD)检测:这是一种针对治疗后体内残留的微量癌细胞、肿瘤相关异常细胞或分子的检测技术。手术、放疗、化疗等治疗虽能大幅减少肿瘤细胞,但极少量隐匿的残留癌细胞可能成为复发根源。MRD检测可发现常规临床手段难以察觉的微量癌细胞,从而更精准地评估病情、预测复发风险。
靶向药物维持治疗:精准抑制残留病灶
靶向药物副作用相对较小,患者耐受性较好,适合长期使用以巩固治疗效果。对存在明确靶点的癌症患者(如HER2阳性乳腺癌、EGFR突变肺癌),治疗结束后使用靶向药物进行维持治疗,能持续抑制体内可能残留的癌细胞,降低复发转移风险。
免疫细胞疗法:激活免疫系统的"抗癌防线"
免疫细胞是人体天然的“抗癌卫士”,但癌症患者的免疫细胞常存在功能受损或数量不足的问题。而免疫细胞疗法(包括CAR-T、TCR-T、TIL、NK、CAR-NK、γδT细胞疗法等),号称为身体“定制抗癌军团”,通过体外激活、扩增患者自身的免疫细胞,再回输体内增强抗癌能力,成为预防复发转移的新选择。
1、CAR-T细胞疗法
CAR-T细胞疗法因全球首位接受治疗的白血病患儿艾米莉(Emily)而广为人知。2010年,5岁的艾米莉确诊急性淋巴细胞白血病(ALL),经两年化疗后癌细胞仍急剧扩散,甚至无法接受骨髓移植。但她入组接受CAR-T细胞治疗仅23天便实现临床治愈,截至2025年已无癌生存13年,创造了生命奇迹。
近年来,CAR-T疗法在实体瘤领域的研究逐步拓展。《免疫前沿》曾报道一例振奋案例:一名60岁乙肝病毒相关肝细胞癌(HCC)患者,在肝肿瘤切除、动脉化疗栓塞(TACE)及肺转移灶消融术后出现肝内复发与肺转移。经CAR-GPC3T细胞(CT011)联合索拉非尼治疗后,患者达到完全缓解(CR),生存期显著延长。甲胎蛋白(AFP)从基线降至正常范围(≤9ng/mL)并长期维持。治疗12个月后,4个靶病灶中3个完全消失,剩余纵隔淋巴结术后病理证实无肿瘤细胞残留。截至首次细胞输注后,患者已实现36个月无进展生存,完全缓解(CR)状态持续超24个月。
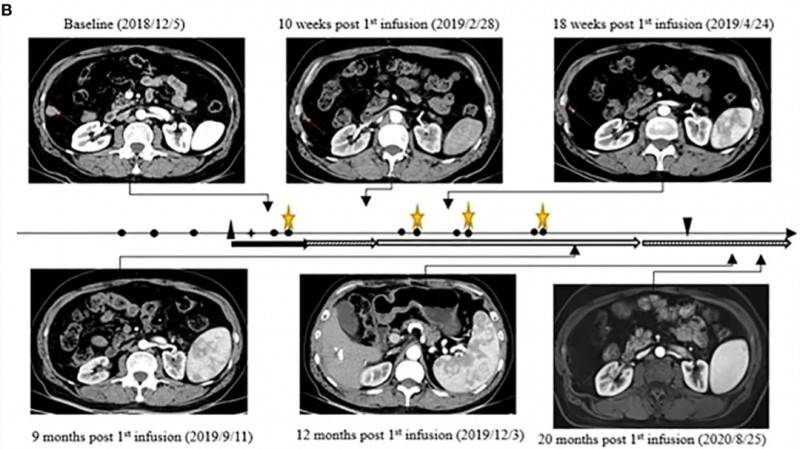
▲图源“Front Immunol”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
2、肿瘤浸润淋巴细胞(TIL)疗法
TIL细胞疗法是从肿瘤组织中分离浸润T细胞,经体外培养扩增后回输体内。这类T细胞本身具备识别癌细胞的能力,回输后可精准攻击残留病灶,目前在黑色素瘤、肺癌、肝癌、宫颈癌、乳腺癌、卵巢癌等实体瘤的复发预防研究中显示良好前景。
日本曾报道过一则具有里程碑意义的案例:这是T细胞免疫疗法首次成功应用于晚期乳腺癌,也是目前文献中该疗法联合化疗治疗乳腺癌的最长存活案例。这是一位46岁HER2阳性转移性乳腺癌(3A期)患者,接受根治术后,第1年针对颈淋巴结转移加用化疗和放疗,后续持续化疗8年因副作用无法耐受,出现肿瘤标志物升高+淋巴细胞耗竭。遂入组接受2个疗程ATL免疫细胞治疗。
结果显示:治疗前,影像学检查可见右胸腔内有胸腔积液(黑色箭头);免疫细胞治疗后,胸腔积液完全消失(详见下图),且淋巴细胞功能恢复,肿瘤标志物回归正常,日常活动能力改善。此后10年里,间歇性接受免疫细胞治疗联合曲妥珠单抗+阿那曲唑化疗,截至2021年(初次手术后25年)仍存活且状态良好。
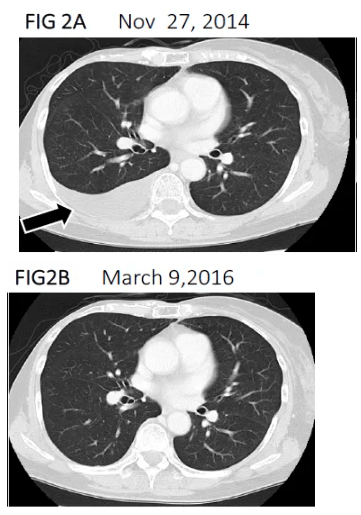
▲图源“BJCR”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
3、NK细胞疗法
NK细胞是免疫系统的“第一道防线”,无需提前致敏即可直接杀伤癌细胞。对实体瘤患者而言,NK细胞疗法通过体外扩增后回输,可增强机体对微小残留病灶的清除能力,尤其适合术后辅助预防复发。
2022年美国癌症研究学会(AACR)报道过一则经典案例:一名37岁男性高度难治性霍奇金淋巴瘤患者,虽经10线治疗(包括大剂量化疗/自体干细胞移植、CAR-T疗法、派姆单抗及GDP、ABVD等化疗方案)仍效果不佳,入组前影像学显示全身弥漫性淋巴结病变及骨、肺转移。但接受AFM13-NK细胞治疗后,全身病灶明显减少,最终奇迹般获得完全缓解(CR)。
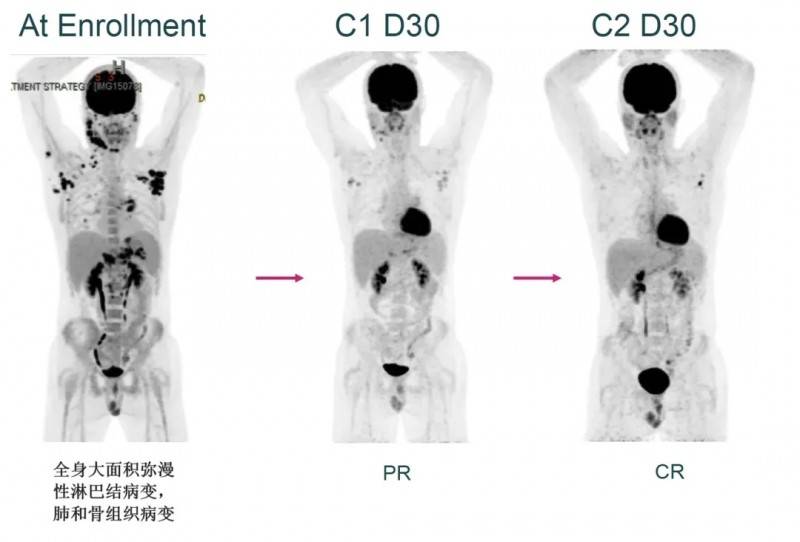
▲图源“AFFIMED”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
癌症疫苗:让免疫系统"记住"癌细胞
癌症疫苗通过激活免疫系统对癌细胞的“记忆”,持续监视并清除潜在复发癌细胞,如同流感疫苗预防感冒般筑起长期防护屏障。临床常见类型包括古巴肺癌疫苗、mRNA癌症疫苗、树突状细胞(DC)疫苗等。其中DC细胞作为免疫系统“哨兵”,可识别癌细胞并激活T细胞,DC疫苗通过体外培养加载肿瘤抗原的DC细胞回输,能有效启动免疫应答,在前列腺癌、肾癌等实体瘤中已证实可延长无病生存期、降低复发风险。
《医学病例报告杂志》报道过一则振奋案例:一位63岁EGFR突变的Ⅲb期肺腺癌患者(PD-L1表达不足1%,未接受过化疗)因无法手术,遂接受WT1/MUC1-DC疫苗+厄洛替尼联合治疗。
结果显示:治疗前左下肺有35mm×30mm病灶;联合治疗第237天,肿瘤缩小至12mm(足足缩小了65.7%,详见下图),第321天(接种10次疫苗后)CT未检测到肿瘤。截至统计时,患者已实现587天零复发、零转移的生存奇迹。
▼癌患者DC疫苗治疗前、治疗后CT和PET/CT对比
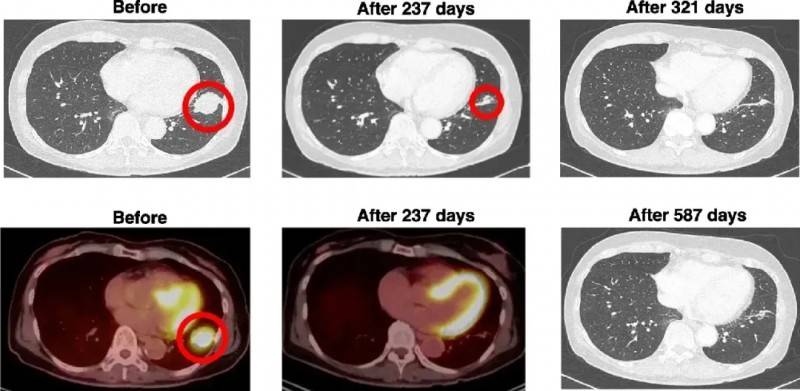
▲图源“BMC”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
小编寄语
癌症转移与复发虽均威胁生命,但转移因癌细胞恶性程度更高、治疗难度更大、对生存率影响更致命,总体预后比复发更差。不过,随着靶向治疗、免疫治疗、精准放疗等技术发展,部分转移患者也能实现长期生存。
但小编也需提醒广大癌友,癌症作为一种极其狡猾并高度突变的疾病,其预防和治疗不是一蹴而就的。早发现、规范治疗和定期监测是核心;同时手术、放化疗在癌症治疗领域的地位不可撼动;在此基础上,患者可结合自身情况辅助免疫细胞疗法、癌症疫苗、饮食调理等手段,复发癌症复发/转移、提高生活质量、尽可能延长生存期。
如果您对目前的治疗方案不满意,想寻求前沿检测手段、新兴抗癌技术的帮助,可将治疗经历、病理报告等,提交至医学部,进行初步评估或申请国内外抗癌专家会诊。
参考资料
[1]Sun H,et al.Long term complete response of advanced hepatocellular carcinoma to glypican-3 specific chimeric antigen receptor T-Cells plus sorafenib, a case report. Front Immunol. 2022 Aug 17;13:963031.
https://pmc.ncbi.nlm.nih.gov/articles/PMC9428446/
[2]Shindo G,et al. Long-term, 25-year Survival Following Surgery and Immune Cell Therapy Combined with Chemotherapy for HER2-Positive Metastatic Breast Cancer[J].
https://britishjournalofcancerresearch.com/long-term-25-year-survival-following-surgery-and-immune-cell-therapy-combined-with-chemotherapy-for-her2-positive-metastatic-breast-cancer
[3]Kosumi T,et al.Dendritic cell vaccination in combination with erlotinib in a patient with inoperable lung adenocarcinoma: a case report[J]. Journal of Medical Case Reports, 2024, 18(1): 88.
https://jmedicalcasereports.biomedcentral.com/articles/10.1186/s13256-024-04363-z
[4]https://www.affimed.com/affimed-announces-oral-presentation-of-phase-1-2-data-from-afm13-in-combination-with-allogeneic-nk-cells-at-the-2023-ash-annual-meeting/
