卵巢癌分子检测的临床应用
根据IARC 2022年全球癌症负担数据,全球卵巢癌年新发32.4万例,死亡20.7万例,在女性罹患癌种中均排名第八。根据国家癌症中心的数据,我国卵巢癌年新发6.1万例,死亡3.3万例,在女性罹患癌种中均排名第九[1]。卵巢癌的病死率位于女性生殖道恶性肿瘤之首,就诊时70%的患者已处于晚期,迄今晚期卵巢癌的5年生存率仍在30%~40%。由于不同组织学亚型卵巢癌的分子生物学机制和预后各不相同,需进行的检测和治疗方法亦应有所区别。
卵巢癌的主要组织学亚型及其所占比例如下:高级别浆液性癌(high‑grade serous carcinoma,HGSC)占 70%~80%,子宫内膜样癌(endometrioid carcinoma,EC)占 10%,透明细胞癌(clear cell carcinoma,CCC)占10%,黏液性癌(mucinous carcinoma,MC)占 3%,低级别浆液性癌(low‑grade serous carcinoma,LGSC)<5%,不同组织学亚型具有不同基因突变特征[2-4]。
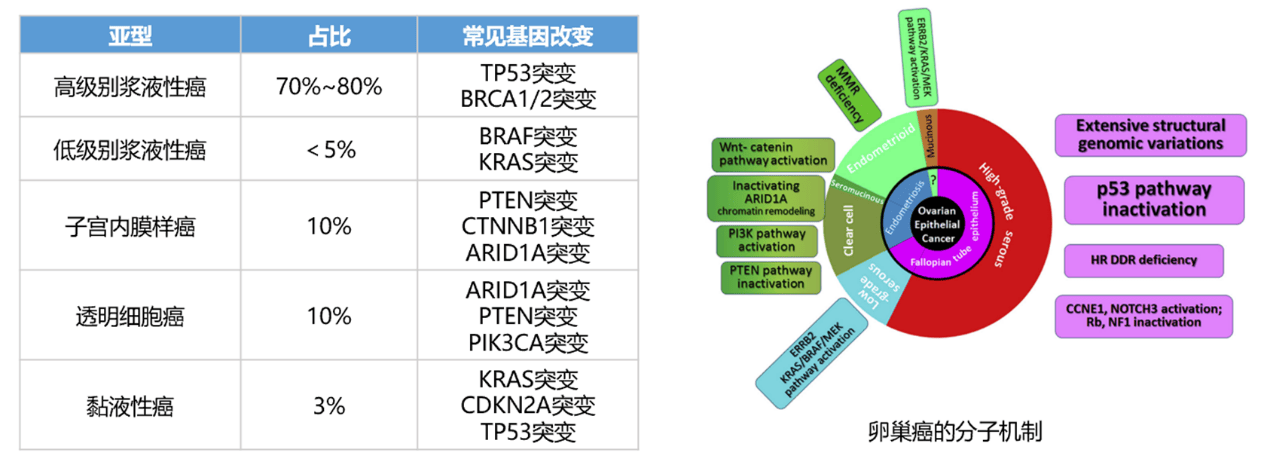 卵巢癌常见病理亚型和相应基因改变
卵巢癌常见病理亚型和相应基因改变
卵巢癌分子病理检测的临床意义主要包括:评估患者及其家族成员遗传相关肿瘤的发病风险、筛选靶向治疗和免疫治疗的获益人群以及判断预后3个方面。
遗传风险评估
10%~15%的卵巢癌患者与遗传性肿瘤综合征相关,其中最常见的是遗传性乳腺癌卵巢癌综合征(hereditary breast and ovarian cancer,HBOC)和Lynch综合征(Lynch syndrome,LS),占遗传性卵巢癌的90%。HBOC主要与乳腺癌易感基因BRCA1/2胚系突变有关;而LS主要与错配修复(mismatch repair,MMR)基因(MLH1、MSH2、MSH6、PSM2)以及EPCAM基因胚系突变有关[5]。
研究表明肿瘤相关基因的胚系突变携带者发生相关癌症的风险明显高于普通人群。BRCA1/2是抑癌基因,参与DNA的同源重组修复(homologous recombination repair,HRR),是该修复过程中的关键基因。研究显示,卵巢癌患者中BRCA的突变率为22.3%(BRCA1 17.1%,BRCA2 5.3%),健康人群中BRCA的突变率为0.4%(BRCA1 0.3%,BRCA2 0.1%)[6],BRCA1和BRCA2突变携带者,到80岁时的累计卵巢癌罹患风险分别为44%和17%[7]。除了BRCA1/2基因外,HRR通路的其他基因如ATM、BRIP1、RAD51C、RAD51D、PALB2等发生突变后,也可导致卵巢癌发病风险升高。
林奇综合征(LS)则主要是由DNA错配修复基因(MMR)突变导致,患者不仅患卵巢癌的风险增加,还易并发其他多种肿瘤,如结肠癌、子宫内膜癌等。以卵巢癌为首发肿瘤的LS患者,并发另一种肿瘤的中位时间是5.5年,终生并发另一种肿瘤的风险为6% -12% 。此外,PJS综合征(以特定部位皮肤黏膜色素斑和胃肠道多发错构瘤息肉为特征的常染色体显性遗传病)患者卵巢癌发病风险率也高达21%。
根据基因检测的结果,可有效预测疾病的发病风险,同时可以有效采取风险管理措施,目前指南共识都有提及根据检测结果进行疾病管理。
 遗传性卵巢癌相关基因变异及风险管理流程
遗传性卵巢癌相关基因变异及风险管理流程
治疗方案决策
卵巢癌传统治疗方式是手术联合以铂类药物为基础的化疗,初次一线化疗的缓解率可达80%以上,但70%的患者会在治疗后3年内复发,复发后患者的中位总生存期(overall survival,OS)约为2年。随着分子检测与靶向治疗的进展,卵巢癌的治疗模式发生了重大变革,一线治疗形成了“手术+化疗+维持治疗”的慢病化全程管理模式。根据卵巢癌不同组织学亚型的常见基因突变特征,可以制定个性化靶向治疗方案,为卵巢癌患者提供最佳的治疗策略。
卵巢癌分子病理检测有助于筛选靶向治疗、免疫治疗、内分泌治疗及抗体药物耦联物(antibody‑drug conjucate,ADC)治疗的可能获益人群,有助于个体化精准治疗方案的选择。NCCN卵巢癌、输卵管癌、原发性腹膜癌诊疗指南推荐新发卵巢患者检测BRCA1/2或HRD。胚系和体系BRCA1/2(g&sBRCA)状态提示维持治疗疗效。复发患者可检测HER2、BRCA1/2、HRD、MSI/MMR、TMB、BRAF、FRα(FOLR1)、RET、NTRK等生物标志物[8]。CSCO卵巢癌诊疗指南对于卵巢癌分期/减瘤术标本,I级推荐胚系/体细胞BRCA1/2等同源重组修复通路基因突变检测[9]。
目前PARPi治疗相关的分子标志物主要是BRCA1/2突变和HRD。FDA/NMPA已批准多款PARPi用于治疗携带BRCA1/2胚系突变或BRCA1/2突变(胚系和体细胞突变)或HRD阳性的卵巢癌患者。2022年6月、8月和9月,卢卡帕利、奥拉帕利、尼拉帕利相继撤回了其用于多线复发卵巢治疗的适应症,因为长时间的随访观察发现,在多线复发的卵巢癌患者中,PARP抑制剂的应用疗效并不优于化疗。NCCN指南仍有推荐,只是证据等级从2A降至3类。
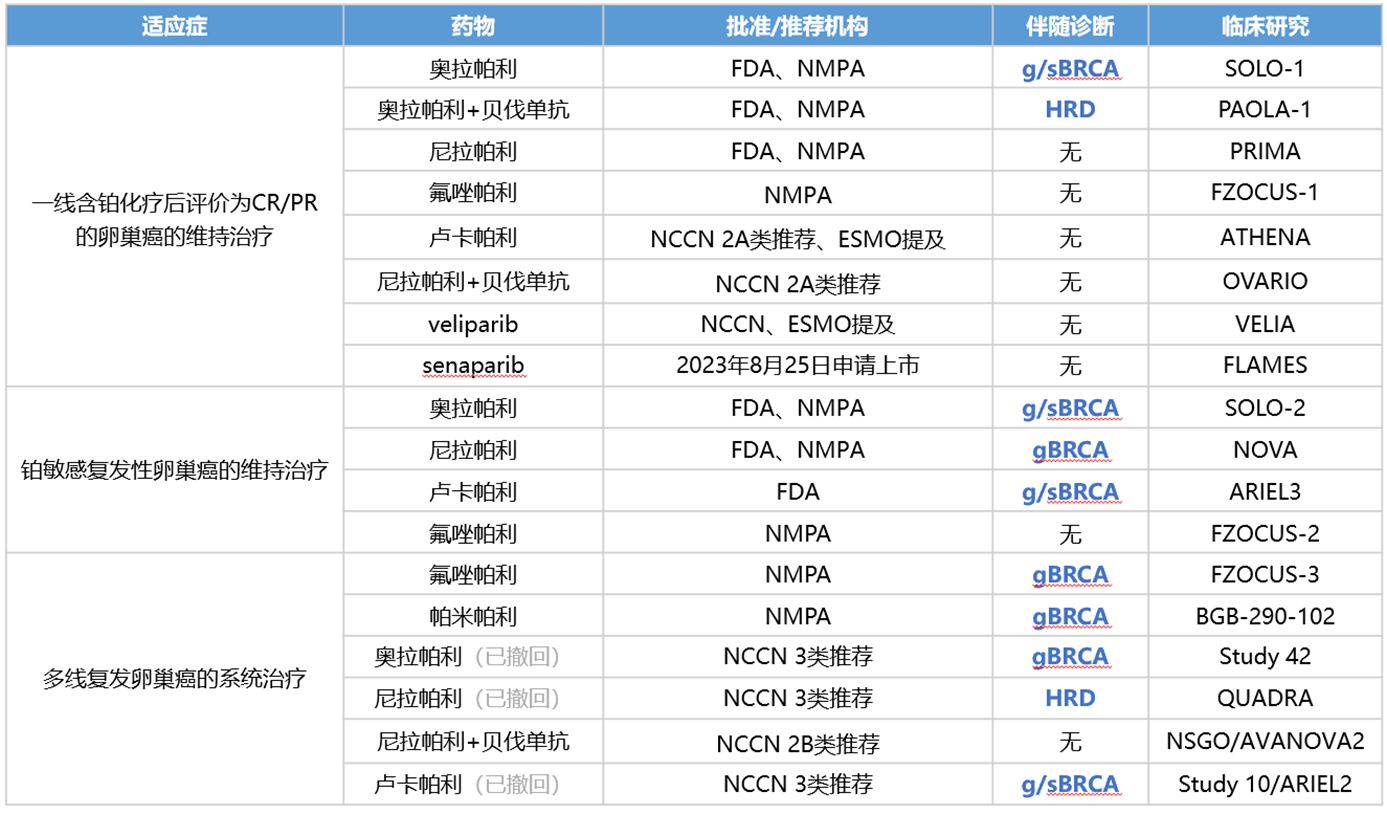 PARP抑制剂在卵巢癌中的适应症
PARP抑制剂在卵巢癌中的适应症
复发患者可检测HER2、BRCA1/2、HRD、MSI/MMR、TMB、BRAF、KRAS、FRα(FOLR1)、RET、NTRK等生物标志物,进行用药推荐。针对BRAF V600E突变、RET融合、NTRK融合、错配修复蛋白缺陷(dMMR)/高度微卫星不稳定性(MSI‑H)等少见/罕见变异的靶向治疗或免疫治疗也可能为携带这些变异的晚期复发卵巢癌患者带来生存获益。
 NCCN指南针对复发患者的靶向免疫治疗推荐[8]
NCCN指南针对复发患者的靶向免疫治疗推荐[8]
检测时机的选择
基因检测不仅优化了现有治疗方案,更推动了卵巢癌治疗模式的革命性变革。这种变革体现在三个维度:治疗时机的前移、治疗强度的个体化调整、联合治疗策略的创新。基因检测的临床价值能否充分发挥,很大程度上取决于检测时机的合理选择。不同病程阶段的检测目的不同,产生的决策影响也存在显著差异。
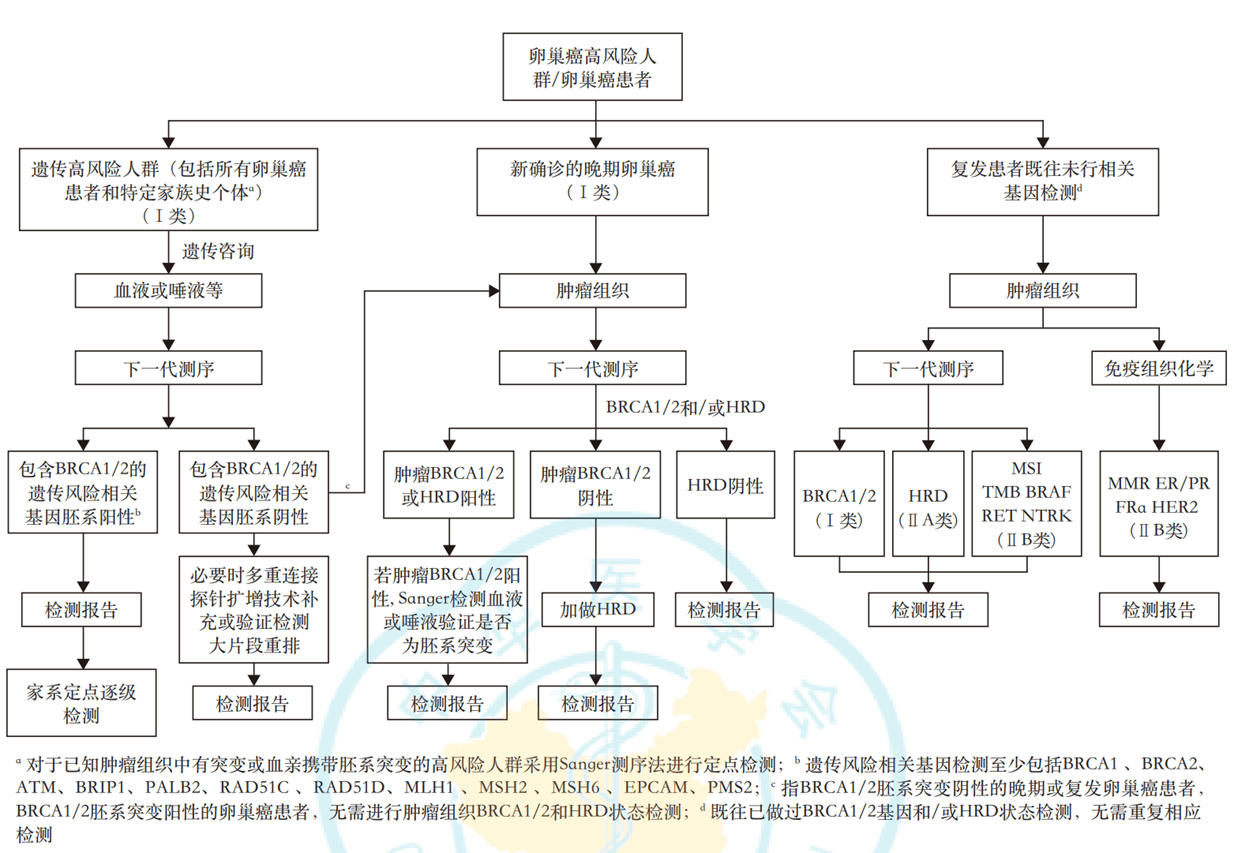 卵巢癌分子病理检测策略与路径
卵巢癌分子病理检测策略与路径
针对遗传高风险人群,推荐进行卵巢癌遗传易感相关基因胚系突变检测,同时推荐在胚系突变检测前后对患者进行遗传咨询,遗传易感基因检出结果阳性者建议对其家系进行定点逐级检测,遗传易感基因检出结果阴性者,必要时进一步行MLPA检测。
针对新诊断的卵巢癌患者,推荐进行上述遗传易感基因评估;推荐对所有新确诊的晚期卵巢癌患者进行外周血或肿瘤组织BRCA1/2基因检测和/或HRD状态检测。
针对复发患者,推荐对既往未行相关基因检测的复发患者进行肿瘤组织基因检测,包括但不限于HER2、BRCA1/2、HRD、MSI/MMR、TMB、BRAF、KRAS、FRα(FOLR1)、RET、NTRK等生物标志物。
总结
近年来,卵巢癌精准诊疗领域进展迅速,分子检测逐步渗入到卵巢癌全流程管理,但同样的也存在一些问题,分子检测技术的准确性和可靠性有待进一步提高,不同的检测方法、检测平台以及检测实验室之间可能存在一定的差异,这可能会影响检测结果的准确性,此外,分子检测的成本相对较高,在一定程度上限制了其在临床中的广泛应用。随着科学技术的不断进步,将有助于提高分子检测在卵巢癌临床实践中的应用水平,推动卵巢癌诊疗向更加精准化、个体化的方向发展。
参考文献
[1]J Natl Cancer Cent. 2024,4(1):page
[2]CSCO卵巢癌诊疗指南2024
[3]WHO肿瘤分类第5版:女性生殖系统肿瘤
[4]Am J Pathol. 2016 Apr;186(4):733-47.
[5]DOI:10.3760/cma.j.cn112151-20240904-00594
[6]Gynecol Oncol. 2018 Oct; 151(1): 145-152.
[7]JAMA. 2017 Jun 20; 317(23): 2402-2416.
[8]NCCN卵巢癌、输卵管癌、原发性腹膜癌诊疗指南2025.v2
[9]CSCO卵巢癌诊疗指南2024
声明:本文仅用于分享,如涉及版权等问题,请尽快联系我们,我们第一时间更正,谢谢!
上一篇:学生元旦表演什么节目?
下一篇:催眠后是灵魂还是潜意识
