福建医科大学/福建中医药大学联合发文:肝癌治疗新靶点,免疫代谢双管齐下
【导读】可变剪接(AS)在肿瘤进展中发挥着重要作用。然而,可变剪接因子 RBM17 在肝细胞癌(HCC)进展中的作用尚未阐明。
近日,福建医科大学/福建中医药大学研究人员合作共同在期刊《Cell Death Discovery》上发表了研究论文,题为“RBM17 promotes hepatocellular carcinoma progression by regulating lipid metabolism and immune microenvironment: implications for therapeutic targeting”,本研究结果表明,RBM17 在肝细胞癌(HCC)组织中显著过表达,并且与不良预后呈正相关。研究人员发现 RBM17 表达与 M2 巨噬细胞浸润呈正相关。从机制上讲,RBM17 通过诱导牛磺胆酸(T-CA)的生成促进 M2 巨噬细胞浸润,这是通过增强 CSAD 前体 mRNA 的外显子排除来实现的。此外,RBM17 通过调节 HACD3 前体 mRNA 的外显子跳跃来调节脂肪酸代谢和 CD8+ T 细胞浸润。另外,RUNX1 激活 RBM17 表达,并调节下游的 CSAD/T-CA 和 HACD3/FFA 信号传导。重要的是,靶向 RBM17 可以阻止 HCC 的进展,表明其作为 HCC 治疗靶点的潜力。本研究结果为 HCC 中免疫细胞浸润和代谢的潜在机制提供了新的见解,并将 RBM17 确定为有前景的治疗靶点。

研究背景
01
肝细胞癌(HCC)具有发病率高、死亡率高、早期诊断困难以及对化疗不敏感等特点。由于存在基因组复杂性和表观遗传多样性等复杂的分子机制,HCC 在临床和分子层面都表现出高度异质性。目前,HCC 的治疗选择主要包括酪氨酸激酶抑制剂,如索拉非尼和乐伐替尼。免疫疗法是 HCC 治疗的新领域;然而,当患者免疫功能减弱时,通过免疫疗法可能无法改善其生活质量或预后。此外,HCC 细胞中存在许多阻碍抗肿瘤免疫反应的因素,包括细胞免疫和体液免疫系统的异常、T 细胞表面标志物的变化以及其他因素。这些因素导致了 HCC 病理生理过程的复杂性和多样性,使得免疫疗法极具挑战性。这种治疗困境凸显了迫切需要能够同时破坏代谢依赖性和逆转免疫耗竭的新治疗靶点。
RBM17 与肝细胞癌患者的不良预后相关
02
为评估 AS 因子与肝细胞癌(HCC)预后之间的关联,研究人员进行了多变量 Cox 比例风险回归分析,并使用“Forestplot”软件包绘制了森林图。结果表明,RBM17 是最显著的独立风险因素。为分析 RBM17 差异表达水平与 HCC 患者预后的关系,研究人员将 RBM17 分为高表达和低表达两组。高 RBM17 表达的 HCC 患者预后较差。此外,研究人员进一步比较了 RBM17 高表达和低表达的临床特征分布,发现 RBM17 高表达组的性别特征与 RBM17 低表达组相比有显著差异,而年龄、放疗和新辅助治疗方面则无显著差异。基于这些发现,研究人员采用免疫组织化学(IHC)评估了 HCC 组织微阵列中 RBM17 的表达。癌组织中 RBM17 的表达水平显著高于癌旁组织。研究人员从二乙基亚硝胺(DEN)诱导的肝细胞癌(HCC)小鼠的肝组织中提取了原代实质细胞,发现 HCC 组中 RBM17 蛋白的表达水平显著上调。研究人员还分析了 HCC 患者的肝组织,发现 RBM17 的表达与肿瘤大小和甲胎蛋白(AFP)值呈正相关,表明其可能在 HCC 进展和不良预后中发挥潜在作用。
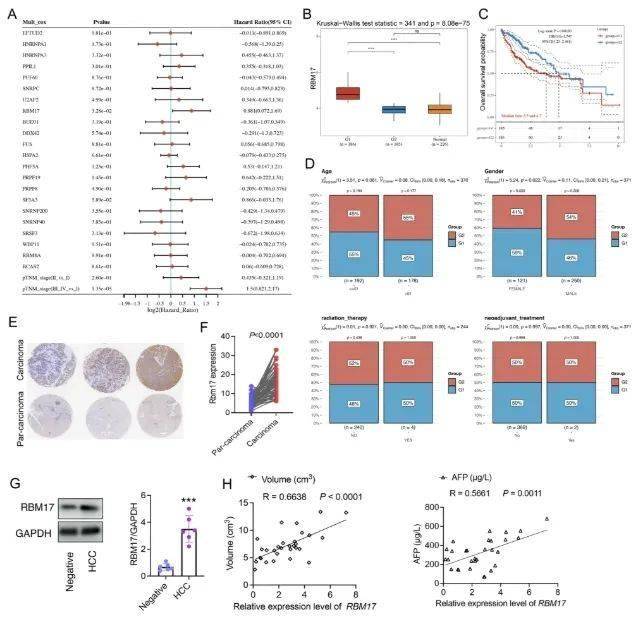
AS 因子 RBM17 与肝细胞癌患者的不良预后相关
结论
03
本研究强调了 RBM17 因子在肝细胞癌(HCC)肿瘤代谢和生长中的关键作用。通过促进 T-CA 和 FFA 的分泌,RBM17 增强了 M2 巨噬细胞的浸润,但抑制了 CD8+ T 细胞的浸润,最终促进了免疫抑制。这一发现凸显了 RBM17 在肿瘤免疫学和生长中的重要性,表明其有可能成为未来治疗策略的靶点。
参考资料:
【关于投稿】
