CCR:阑尾腺癌血浆ctDNA检测的基因组谱,阳性患者预后差

阑尾腺癌(AA)是一种罕见恶性肿瘤,具有独特的组织病理学亚型,其自然病程中转移主要局限于腹膜。相较于常见肿瘤,人们对AA分子发病机制的了解仍十分有限。研究者首先分析了Guardant Health数据库中阑尾癌患者(n=718)的分子数据。随后,研究者纳入了该院2004年10月至2022年9月期间接受过循环肿瘤DNA(ctDNA)突变检测(液体活检)的AA患者(n=168),并提取了他们的临床病理特征及预后数据。在这168例患者中,有57例同时接受过基于肿瘤组织的突变检测,这使得研究者能够评估液体活检与组织活检检测结果的一致性。
AA患者ctDNA的突变特征与基于组织的测序结果存在差异,其中TP53是最常见的突变基因(突变率46%)。与其他肿瘤相比,AA释放ctDNA的可能性更低:仅38%的转移性AA患者可检测到ctDNA(相较于结直肠癌(CRC),比值比OR=0.26,p<0.0001)。即使检测到ctDNA,AA患者的中位变异等位基因频率(VAF)也显著低于CRC(AA为0.4%,CRC为1.3%,p≤0.001)。高级别、印戒细胞型或结肠型组织学特征、腹膜外转移以及TP53突变,均与可检测到的ctDNA相关。在临床转化方面,ctDNA检测阳性的患者总生存期更短(HR=2.32,p=0.048)。在Guardant Health数据库队列中,93例患者(13.0%)检测出可干预突变。
尽管与CRC相比,转移性AA肿瘤向血液中释放肿瘤DNA的可能性更低,但ctDNA检测在AA中仍具有临床应用价值。
研究背景
阑尾腺癌(AA)是一种罕见癌症,根据肿瘤分级(高级别与低级别)可分为不同临床病程。与结直肠癌(CRC)及其他胃肠道恶性肿瘤不同,AA极少通过血行转移,而更倾向于转移至腹膜。因此,AA患者特别适合接受肿瘤细胞减灭术(CRS)联合腹腔热灌注化疗(HIPEC)治疗——通过这种方式,腹膜转移病灶可被切除,从而达到治愈目的。然而,目前我们对“肿瘤-腹膜界面”以及肿瘤远处转移潜能的理解仍不充分,这给临床医生带来了诸多限制,包括难以筛选合适的手术患者、制定全身治疗方案,以及深入了解这种罕见疾病。
检测AA患者外周血中的体细胞突变特征,为理解肿瘤发生发展的分子机制提供了途径。但由于技术限制以及AA原发肿瘤的罕见性,目前对其突变特征的研究仍较为有限。尽管从解剖位置相近性和胚胎起源一致性来看,AA在历史上曾被认为与CRC相似,但近年研究表明,两者在分子水平上存在显著差异。AA具有独特的驱动基因突变特征:TP53、KRAS和GNAS突变较为常见,而CRC的标志性突变——APC突变,在AA中却罕见。此外,研究已证实,AA中KRAS、GNAS、TP53等关键驱动基因的突变状态,兼具预后评估与疗效预测价值。
除肿瘤突变特征外,近年来循环肿瘤DNA(ctDNA)可靠测序技术的进步,不仅能确定肿瘤突变状态,还为研究“肿瘤-腹膜-全身循环”的生物学界面提供了新视角。在其他癌症类型中,ctDNA已被证实可作为生物标志物,应用于晚期癌症患者基因分型、预后分层、疾病检测及动态监测,目前已被纳入多种肿瘤的治疗指南。然而,人们对AA患者ctDNA释放的机制与局限性(即肿瘤DNA进入全身循环的程度)仍知之甚少。虽然ctDNA释放受转移灶解剖位置、肿瘤细胞固有特性(如细胞分裂速率)及治疗对ctDNA释放的影响等因素调控,但仍需进一步明确腹膜转移与AA的具体关联。尽管人们对通过ctDNA检测(液体活检)识别驱动体细胞突变、监测治疗反应及检测微小残留病灶(MRD)的潜力抱有浓厚兴趣,但此前关于AA中ctDNA检测敏感性的研究报道结论不一。目前关于AA中ctDNA的研究较少,且现有研究不仅样本量小,还缺乏肿瘤组织检测与ctDNA检测生物标志物的对比分析。因此,本研究通过分析AA患者的肿瘤突变与循环突变特征,旨在揭示这类罕见肿瘤的生物学特性及转移机制。
研究结果
阑尾腺癌患者的基因突变特征分析:
为评估AA患者ctDNA的突变特征,研究者分析了Guardant Health基因组数据库中718例确诊AA患者的队列数据。在该Guardant Health队列中,ctDNA的总体致癌突变检出率为68%(718例患者中有491例检测到突变)。与既往报道的体细胞突变频率一致,TP53(46%)和KRAS(29%)是最常见的突变基因(图1A)。ATM突变(17%)的发生率高于既往肿瘤突变研究的预期,而GNAS突变(11%)的发生率则显著更低(36)。CRC中的标志性突变基因APC,在本研究样本中仅11%检测到突变。718例患者中,7例(1.0%)存在微卫星不稳定(MSI-H),与既往报道中AA的MSI-H发生率(0.9%)一致。在732份血液样本中,共检测到1411个变异,其中错义突变最常见(54.2%),其次是同义突变(18%)和插入/缺失(indel,11.7%),仅检测到1例融合事件(0.07%)。拷贝数变异(CNV)也极为罕见,仅检测到65例扩增(4.6%),未检测到缺失(图1B)。所用检测panel本身对缺失变异的检出能力有限。整个队列的中位变异等位基因频率(VAF)为0.5%(范围0.01-82.8%)。循环肿瘤突变负荷(TMB)较低,中位值为6.3 mut/Mb,仅9份(1.2%)样本的TMB超过20 mut/Mb(图1C)。同样,每个肿瘤检测到的变异总数较少(中位值4个,四分位距[2-7]),仅1例MSI-H样本为异常值,检测到95个变异(图1D)。如预期所示,7例MSI-H患者检测到的变异数量显著高于非MSI-H患者(22.9 vs. 2.41,p<0.0001)。通过OncoKB数据库注释可干预突变,在87例独特患者中共识别出94个当前可干预突变,包括6例BRAF V600E突变、11例KRAS G12C突变和62例KRAS G12D突变(图1E)。多个基因对在同一样本中显著富集共现:TP53与KRAS、KRAS与APC、KRAS与PIK3CA、TP53与APC、KRAS与GNAS等(p<0.001;q<0.001),提示这些基因可能协同促进肿瘤发生,且与已知的AA突变亚型分类一致(图1F)。由于队列统计效力有限,未发现存在统计学意义上互斥的基因对。但已知为Ras/MAPK通路互斥激活因子的KRAS与NRAS,本研究中仅1份样本同时检测到两者突变;且未发现同时存在SMAD4与NF1突变的样本。有趣的是,尽管此前未在AA中报道,但已知SMAD4与NF1可协同形成抑制复合物,以响应TGF-β信号。总体而言,AA的循环基因组特征与既往报道的CRC突变特征存在显著差异。

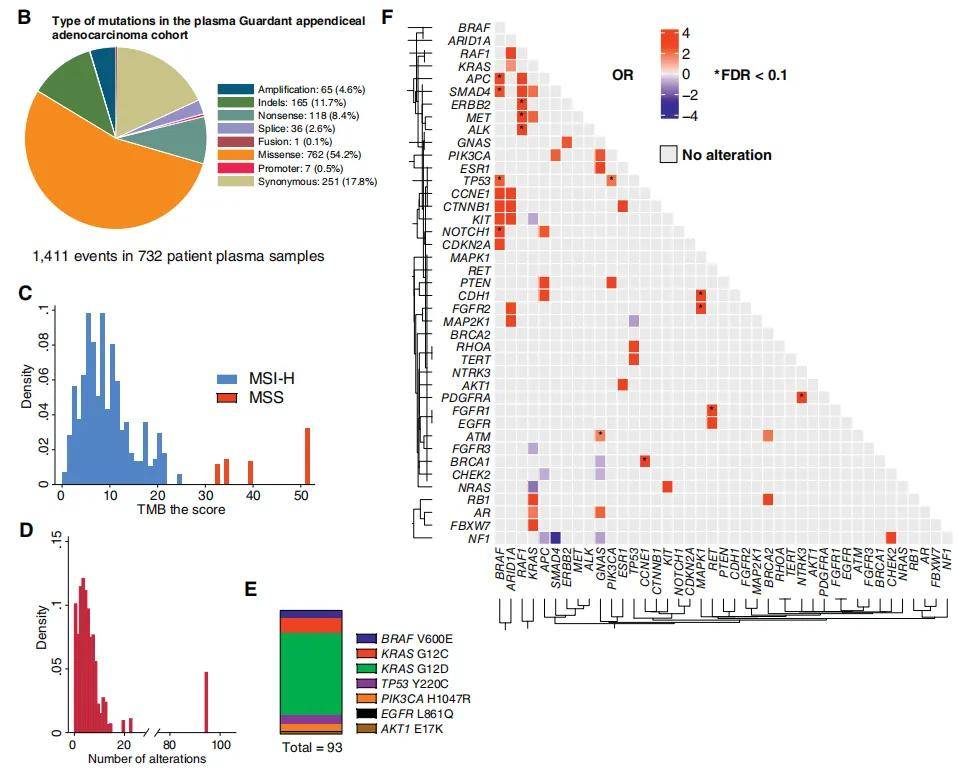

图1
阑尾腺癌中ctDNA检测与临床病理特征的关联:
为进一步评估ctDNA及突变状态与临床特征的相关性,研究者分析了MD安德森癌症中心(MDACC)常规临床诊疗中接受液体活检的AA亚组样本——该亚组具有更完整的临床数据及配对的肿瘤突变数据(表1)。在153例接受液体活检的患者中,58例(38%)检测到ctDNA,其中大多数仅检测到1个体细胞变异。与Guardant队列一致,大多数变异为错义置换(76.9%)。该检出率显著低于同期MDACC的CRC队列(CRC的ctDNA检出率为70%;OR=0.26,p<0.0001,图2A)。随后,研究者比较了血液与肿瘤组织中的体细胞突变特征。通过分析肿瘤突变与外周血检出突变的比例发现:AA的突变比例与MDACC CRC队列(4941例肿瘤组织、1282例ctDNA)存在差异,且这种差异依赖于突变基因本身,提示体细胞突变特征与DNA释放动态可能存在关联。KRAS是AA肿瘤中最常见的突变基因(47.1%),但在血液样本中突变率仅为8.5%,比例为0.18(图2B);SMAD4的肿瘤与血液突变比例次之,肿瘤突变率14.1%,血液突变率2.6%,比例为0.18;GNAS的这一比例为0.30(肿瘤突变率25.7%,血液突变率7.8%)。与之相反,TP53是ctDNA中最常见的突变基因(18.3%),也是肿瘤组织测序中第二常见的突变基因(27.4%),比例为0.67。相比之下,CRC中最常见的突变基因(TP53、APC、KRAS)在ctDNA与肿瘤组织中的突变频率相对一致,仅ATM、FBXW7和CTNNB1在ctDNA中的突变频率显著降低。

表1


图2
聚焦AA本身,研究者进一步分析了哪些临床特征与ctDNA可检测性相关。已知肿瘤分级是AA最重要的生存预测因素之一,同时也与ctDNA可检测性相关——低分化肿瘤的ctDNA体细胞变异检出率最高(48%),中分化次之(39%),高分化最低(24%)(高分化与低分化比较,p=0.01,图2C)。同样,关于肿瘤组织学类型,印戒细胞癌的ctDNA检出率最高(60%),与非黏液腺癌(57%)、杯状细胞癌(45%)接近;而黏液腺癌的检出率显著更低(30%,与印戒细胞癌比较p=0.03,与杯状细胞癌比较p=0.02,图2D)。
仅腹膜转移患者的ctDNA检出率低于血行转移患者(35% vs. 80%,p=0.005,图2E)。多因素分析证实,上述这些既往被认为与肿瘤侵袭性生物学特征相关的因素,以及神经周围侵犯,均是ctDNA可检测性的独立预测因素,提示ctDNA可能是血-腹膜屏障破坏及局部肿瘤侵袭性增强的替代标志物。
在ctDNA定量方面,AA患者的中位循环VAF显著低于CRC患者(中位VAF 0.4% vs. 1.3%,p≤0.001,Mann-Whitney检验),且AA中未检测到VAF超过0.1%的变异(图2F)。所有基因的VAF均显示AA低于CRC。同样,高、中、低分化肿瘤之间的VAF无显著差异;术前ctDNA检测阳性患者中,腹膜疾病负荷与VAF也无相关性(R²=0.018,p=0.46),提示ctDNA状态可能与肿瘤微观生物学特征相关,而非宏观疾病负荷。
血浆与肿瘤组织检测结果的一致性分析:
鉴于肿瘤组织与ctDNA的突变特征存在差异,研究者分析了58例AA患者和241例CRC患者的队列(均同时接受组织和ctDNA检测),以直接评估检测一致性。所有基因的血-组织突变检测总体一致性为96.8%,但该数值主要由“血和组织均未检测到突变”的大量案例(阴性一致性)驱动。10个突变仅在血液中检测到,而在组织测序中未检出,提示若仅对多个转移灶中的一个进行活检,肿瘤空间异质性可能导致假阴性结果。在ctDNA检测panel覆盖的基因中,共检测到104个肿瘤组织突变,其中仅15个在ctDNA中检出,AA的阳性一致性率为20%。这一比例显著低于CRC(20% vs. 50%,p<0.001,图3A)。低分化肿瘤的阳性一致性(27%)显著高于中分化(11%)和高分化肿瘤(7%)(图3B);同样,已知与高级别肿瘤相关的TP53突变(36),其阳性一致性高于KRAS或GNAS(图3C)。这些数据进一步提示,血-腹膜屏障破坏程度及肿瘤分级可能影响ctDNA的检出能力。

图3
生存分析:
ctDNA检测阳性的AA患者,其OS显著短于ctDNA检测阴性的患者(两组中位OS均未达到,风险比HR=2.32,p=0.048)(图4A)。ctDNA阳性相关的不良生存并非仅由肿瘤分级导致:在低分化肿瘤亚组中,ctDNA阳性患者的中位OS为21个月,而ctDNA阴性患者为31个月(HR=2.7,p=0.035,图4B)。由于队列的中位随访时间(37.4个月)有限,暂无法评估高分化或中分化肿瘤患者的OS差异。值得注意的是,血液中检测到KRAS突变的患者生存预后极差:13例患者均在2.5年内死亡(中位OS 21.2个月,而KRAS突变阴性患者的中位OS未达到,HR=6.38,p<0.0001,图4C)。这种关联在GNAS、TP53等其他基因中未观察到,且与肿瘤组织NGS检测结果显示的生存关联存在差异。这些数据凸显了ctDNA检测在AA中的预后价值。

图4
网络分析:
为探究通路变异在AA突变亚型分类中的作用及与患者预后的关联,研究者开展了网络分析:通过卡方检验计算共突变基因(共现与互斥),随后进行KEGG通路富集分析。富集分析将筛选出的基因互作模块归类到不同通路中。在Guardant Health基因组数据库的患者队列中,这些分组间观察到显著重叠。随后,研究者在MDACC队列中关联通路变异与患者预后,结果显示:与仅TP53/DNA损伤应答/细胞周期通路存在突变的患者相比,多个通路同时存在变异的患者总生存期更短。
讨 论
这项研究是迄今为止关于阑尾腺癌中肿瘤不可知(tumor agnostic)循环肿瘤DNA 的最大规模描述。研究者发现,与其他恶性肿瘤相比,AA患者血液中ctDNA的阳性检出率较低。在转移性疾病患者中,MDACC队列中仅38%的患者检测到突变。
Guardant Health队列的ctDNA检出率显著更高(68%),但这很可能是因为MDACC队列中可切除疾病患者较多——这些患者的病变常局限于腹膜,有手术切除的机会。
尽管如此,ctDNA可检测性仍具有显著的预后价值:ctDNA检测阳性的患者OS更短。研究者推测,这与肿瘤自身的微观变化相关,且既往发现的侵袭性标志物与ctDNA阳性存在关联。此外,ctDNA状态与腹膜癌指数(PCI)无相关性,这进一步凸显了血管化不良的腹膜所发挥的屏障作用。因此,AA中的ctDNA状态可作为肿瘤生物学特征的标志物,而非宏观疾病负荷的指标,且能反映多种组织病理因素所体现的肿瘤高侵袭性生物学特征。
在ctDNA阳性与突变状态的关联分析中,研究者发现以TP53突变为主的肿瘤(通常比以RAS突变为主的肿瘤侵袭性更强、基质侵犯更明显),其ctDNA阳性率更高。这与研究者此前报道的TP53突变肿瘤具有更高检测一致性相符,同时也与低分化、印戒细胞组织学类型、神经周围侵犯、血行转移等侵袭性组织病理因素与高ctDNA阳性率相关的结果一致。不同癌症类型的ctDNA检出率存在差异:CRC的检出率超过75%,而原发性中枢神经系统恶性肿瘤等其他肿瘤的检出率不足50%。即使在同一癌症类型(AA)中,因检测方法和研究队列不同,检出率也存在差异,范围从11%到24%不等,另有研究报道检出率为35.6%,与本研究的38%相近。本研究强调,ctDNA或可用于识别低分化肿瘤患者中“肿瘤生物学特征和预后相对较好”的亚群(即组织学为低分化但ctDNA阴性的患者)。这类患者在接受全身治疗后,若疾病获得缓解或维持稳定,可能从肿瘤细胞减灭术中获益。事实上,ctDNA还可能为这类患者的围手术期治疗方案选择及治疗时长决策提供指导。目前,针对ctDNA在AA和CRC治疗决策中作用的临床试验正在进行中(NCT05947838),同时研究人员也在积极探索利用腹腔积液或其他ctDNA检测方法作为替代生物标志物。
循环突变状态的重要性在KRAS突变中体现得最为明显:KRAS突变本身与生存期无相关性,但当在血液中检测到该突变时,患者生存期显著缩短。这一现象在CRC中也有报道——术前检测到KRAS突变与更早的复发风险相关;在胰腺癌中,KRAS突变也被视为不良预测指标。尽管既往研究显示,与无RAS、TP53或GNAS突变的肿瘤相比,以RAS突变为主的肿瘤患者生存期更长,但本研究发现,血液中检测到KRAS突变的患者预后仍较差。由于血液中KRAS突变的检出率较低,目前无法得出明确结论;但可观察到一个趋势(在其他癌症类型中也存在):无论术前还是术后,ctDNA检测阳性的患者往往比阴性患者更早复发。
本研究存在一些局限性,包括回顾性研究设计、Guardant Health队列缺乏临床相关数据,以及MDACC队列为单中心队列。Guardant Health队列的样本检测跨越数年,使用了不同版本的检测panel(覆盖73-83个基因),这意味着部分基因和/或变异可能仅在部分患者中进行了检测。此外,基于液体活检的特性,研究者无法排除“样本中存在低于检测下限的额外变异”的可能性。重要的是,由于许多AA肿瘤生物学行为惰性,且根治性手术后患者预后较好,本研究的临床随访时间相对有限,导致生存分析中未达到中位OS(图4A),该队列的mOS可能需要数年时间才能确定。未来,应在其他大样本量中心开展ctDNA研究,建立跨机构数据库,以更好地了解AA患者在整个诊断和治疗过程(包括手术和化疗干预)中ctDNA阳性的自然病程。
总之,本研究为理解AA生物学特征提供了关键信息——通常认为,仅当病变局限于腹腔时,接受肿瘤细胞减灭术联合腹腔热灌注化疗的AA患者才能从中获益。同时,本研究也是首个探索AA中“基于血液的NGS与肿瘤组织测序一致性”的研究。未来,需对国内外多个中心的汇总数据进行整体分析验证,这一点至关重要。此外,未来研究可通过扩大测序覆盖范围,进一步明确本研究中报道的常见突变与潜在新型生物标志物和预后的关系。最终,研究者希望将这些发现应用于临床试验,探索如何基于肿瘤和/或循环突变状态,为不可切除AA患者和接受根治性切除的AA患者制定个体化治疗方案。本研究数据表明,ctDNA状态在明确AA疾病生物学特征方面具有重要作用,并凸显了ctDNA在指导围手术期全身治疗选择及确定根治性手术时机方面的潜在价值。
转化相关性声明
本研究首次阐述了AA中ctDNA的特征。对于AA患者,尤其是病变局限于腹膜的低级别患者,肿瘤细胞减灭术(CRS)联合腹腔热灌注化疗(HIPEC)可能实现治愈。然而,目前缺乏关于“如何优化患者筛选、制定监测流程及后续治疗方案”的相关数据。本研究明确了AA独特的突变特征及ctDNA检出率。
研究者提出,可将ctDNA作为评估血-腹膜屏障完整性或破坏程度的手段,并用于识别总生存期较差的AA患者亚群。这项研究成果有望在近期应用于AA患者的临床肿瘤诊疗实践。
参考文献:
White MG, Zeineddine MA, Fallon EA, et al. The Landscape of ctDNA in Appendiceal Adenocarcinoma. Clin Cancer Res. 2025;31(3):551-560. doi:10.1158/1078-0432.CCR-24-2474
