高危子宫内膜癌:L1CAM过表达与复发和生存显著相关,联合分子分型更精准筛选预后不良患者
分子分型与L1CAM在高危子宫内膜癌中的作用尚不明确。本研究旨在明确分子谱分析及L1CAM表达与肿瘤复发模式、患者生存情况的相关性。本研究为回顾性队列研究,纳入2006年1月1日至2017年12月31日期间转诊至奥斯陆大学医院妇科肿瘤科的患者。患者进行了L1CAM表达水平检测,并按照 ProMisE 标准进行分子分型。主要研究终点为无复发生存时间(TTR)和癌症特异性生存期(CSS)。
本研究共纳入489例患者,其中486例完成分子分型。具体分型分布如下:37例(8%)为POLE突变型肿瘤,148例(30%)为错配修复缺陷型(MMRd)肿瘤,189例(39%)为p53异常型肿瘤,112例(23%)为无特殊分子谱型(NSMP)肿瘤。L1CAM表达检测结果显示,256例(53%)肿瘤呈高表达,227例(46%)呈低表达,6例(1%)数据缺失。多因素分析结果表明,ProMisE分子分型与TTR显著相关,但与CSS无显著相关性;而L1CAM表达水平与TTR及CSS均显著相关。在纳入ProMisE分子分型与L1CAM表达水平的联合多因素模型中,ProMisE分子分型的统计学意义消失,L1CAM表达水平仍具有显著统计学意义。POLE突变型肿瘤患者预后极佳;p53异常型或L1CAM过表达型肿瘤患者预后不良,且远处复发率较高;MMRd型肿瘤、L1CAM低表达的NSMP型和p53异常型肿瘤患者预后中等。
L1CAM是p53异常组与NSMP组患者的额外不良预后因素。在强化辅助治疗的相关研究中,需对这两类患者给予重点关注。
- 明确了分子分型与L1CAM在高危子宫内膜癌中的作用;
- ProMisE分子分型可独立预测无复发生存时间,但无法独立预测癌症特异性生存期;
- POLE突变型肿瘤患者预后极佳;
- L1CAM过表达是肿瘤复发与患者生存的强效独立预测指标;
- 在p53异常组与NSMP组中,L1CAM过表达与肿瘤远处复发相关。
研究背景
子宫内膜癌(EC)是全球女性第六大常见恶性肿瘤,且发病率呈持续上升趋势。由于该病早期症状出现较早,大多数患者确诊时处于疾病早期。临床会结合多项病理指标将患者进一步分层至不同风险组,以此评估患者的复发风险,并制定个体化辅助治疗方案。
子宫内膜癌前瞻性分子风险分型系统(ProMisE)标准的提出以及淋巴管间隙浸润(LVSI)评估的应用,极大地提升了子宫内膜癌的预后评估效能。上述评估手段已被纳入最新国际诊疗指南,例如欧洲肿瘤内科学会(ESMO)2022年指南以及国际妇产科联盟(FIGO)2023年分期标准。但由于资源限制,分子分型尚未在临床广泛开展,其原因在于该检测需明确p53异常状态、MMRd情况以及POLE突变状态。
L1CAM的表达水平也被证实是子宫内膜癌患者的重要预后因素,且在ProMisE分子分型基础上,检测L1CAM表达可进一步优化风险评估效能。尽管有一项近期研究显示,在纳入63例高危或晚期NSMP子宫内膜癌患者的多因素分析中,L1CAM表达与CSS存在相关性,但L1CAM在不同ProMisE分子分型的高危子宫内膜癌患者中的作用及影响仍不明确。
本研究纳入大样本高危子宫内膜癌患者队列(其中大部分患者仅接受化疗作为辅助治疗),旨在结合ProMisE分子分型与L1CAM表达水平,分析患者的生存情况及肿瘤复发部位。
研究方法
依据ESMO 2016年指南,本研究共纳入489例高危患者,具体分组如下:214例(43.8%)为子宫内膜样腺癌,273例(55.8%)为FIGO Ⅰ-Ⅲ期非子宫内膜样癌,2例(0.4%)为组织学分类未定的肿瘤。在子宫内膜样腺癌亚组中,49例(10.0%)为FIGO ⅠB期G3级(不考虑淋巴管间隙浸润状态),53例(10.9%)为FIGO Ⅱ期,112例(22.9%)为FIGO Ⅲ期。所有患者均接受手术治疗,且术后无残留肿瘤病灶。所有患者均建议接受化疗作为辅助治疗,且在整个研究期间,推荐化疗方案均为卡铂联合紫杉醇。对所有患者进行规律随访,并将肿瘤复发模式分为以下类型:局部复发(阴道及盆腔中央区)、盆侧壁侵犯(含盆腔淋巴结转移)、腹主动脉旁淋巴结转移(伴或不伴盆腔淋巴结转移)以及远处转移。检测子宫内膜癌中POLE基因最常见的五种致病性突变(P286R、V411L、S297F、A456P及S459F),这五种突变约占该基因致病性突变的95%。
研究结果
本研究共纳入489例患者,其中279例(57%)为FIGO Ⅰ/Ⅱ期,210例(43%)为FIGO Ⅲ期(表1)。辅助治疗方案分布如下:357例(73%)患者单纯接受铂类为基础的化疗,3例(1%)患者接受放化疗联合治疗,15例(3%)患者单纯接受外照射放疗,114例(23%)患者未接受任何辅助治疗。420例(86%)患者接受盆腔淋巴结分期清扫术,291例(60%)患者接受腹主动脉旁淋巴结分期清扫术。中位随访时间为6.6年,四分位距为3.6~10.5年。
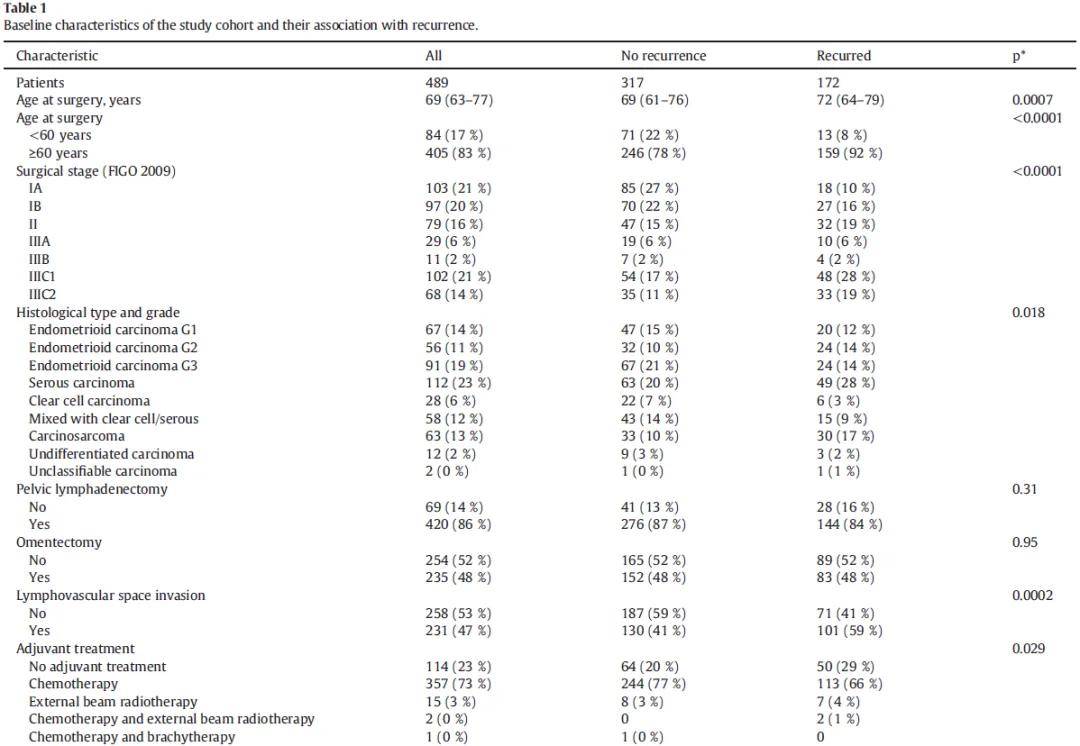
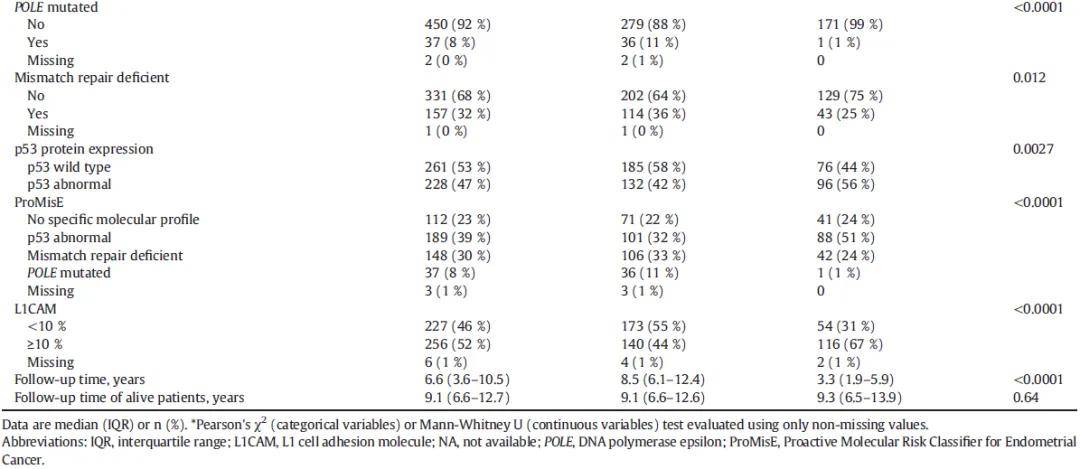
表1
依据ESMO临床实践指南推荐的ProMisE分子分型标准,486例患者完成分型,其中37例(8%)为POLE突变型,148例(30%)为MMRd型,189例(39%)为p53异常型,112例(23%)为NSMP型;剩余3例(1%)因检测结果无法评估未完成分型。L1CAM表达检测结果显示,256例(53%)肿瘤呈高表达,227例(46%)呈低表达,6例(1%)检测结果无法评估。
单因素分析显示,ProMisE分子分型与TTR显著相关(P*< 0.0001);多因素分析中,该相关性仍具有统计学意义(P= 0.027)(图1A)。单因素分析中,ProMisE分子分型与CSS显著相关(P < 0.0001),但在多因素分析中,该相关性无统计学意义(P = 0.074)(图1B)。POLE突变型肿瘤患者预后良好,37例患者中仅1例出现复发,且该患者在初次手术后12年仍存活。单因素及多因素分析均显示,p53异常型肿瘤患者预后较差(图1A、B)。多因素分析结果表明,FIGO分期、组织学类型及分级、年龄、淋巴管间隙浸润(LVSI)以及盆腔淋巴结清扫术均与TTR和CSS显著相关。辅助治疗可显著改善患者的TTR和CSS,且在单因素和多因素分析中均具有统计学意义。
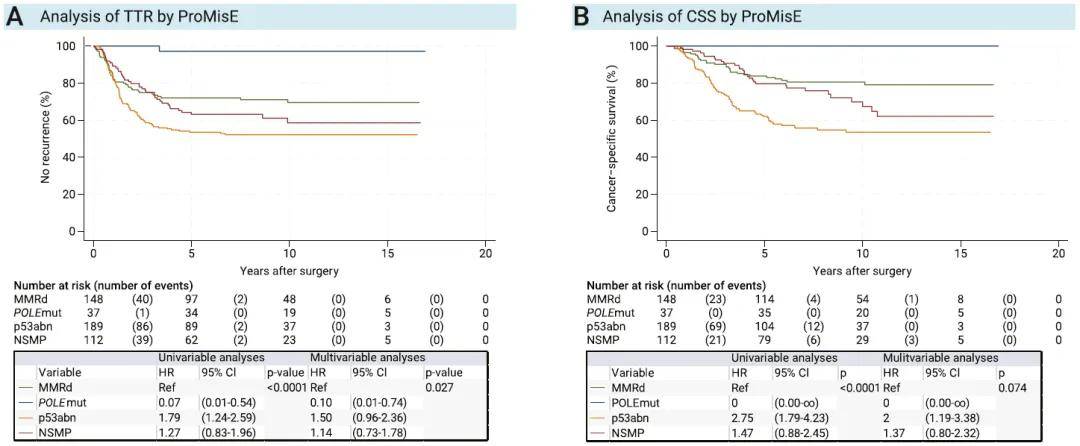
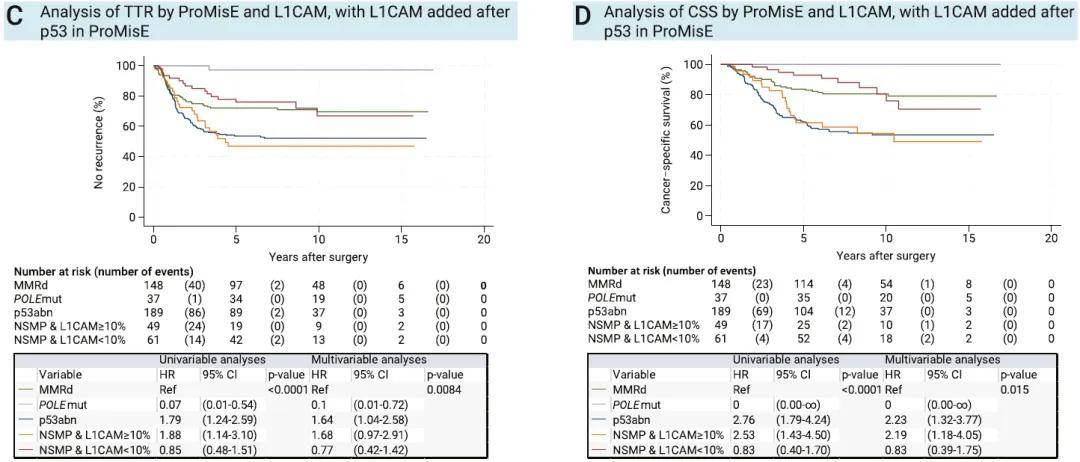
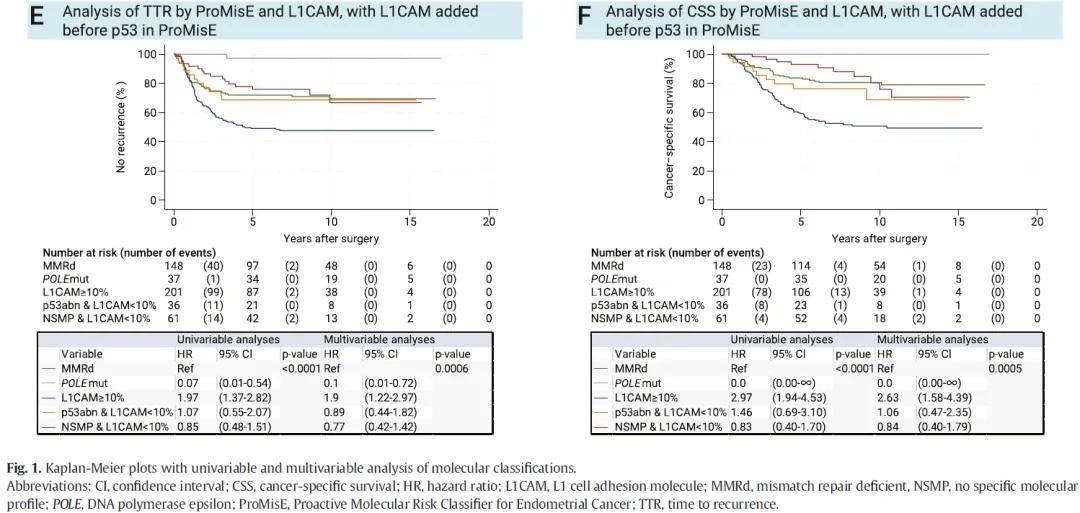
图1
单因素及多因素分析均显示,L1CAM高表达与更短的TTR及CSS相关(P< 0.0001;图2A、B)。无论ProMisE分子分型亚组如何,L1CAM高表达的患者预后均较差,且在p53异常组和NSMP组中,该差异具有统计学意义(图2C-J)。在同时纳入ProMisE分子分型、L1CAM表达水平及已知预后变量的多因素模型中,ProMisE分子分型的统计学意义消失,而L1CAM表达水平仍具有显著统计学意义(表2)。
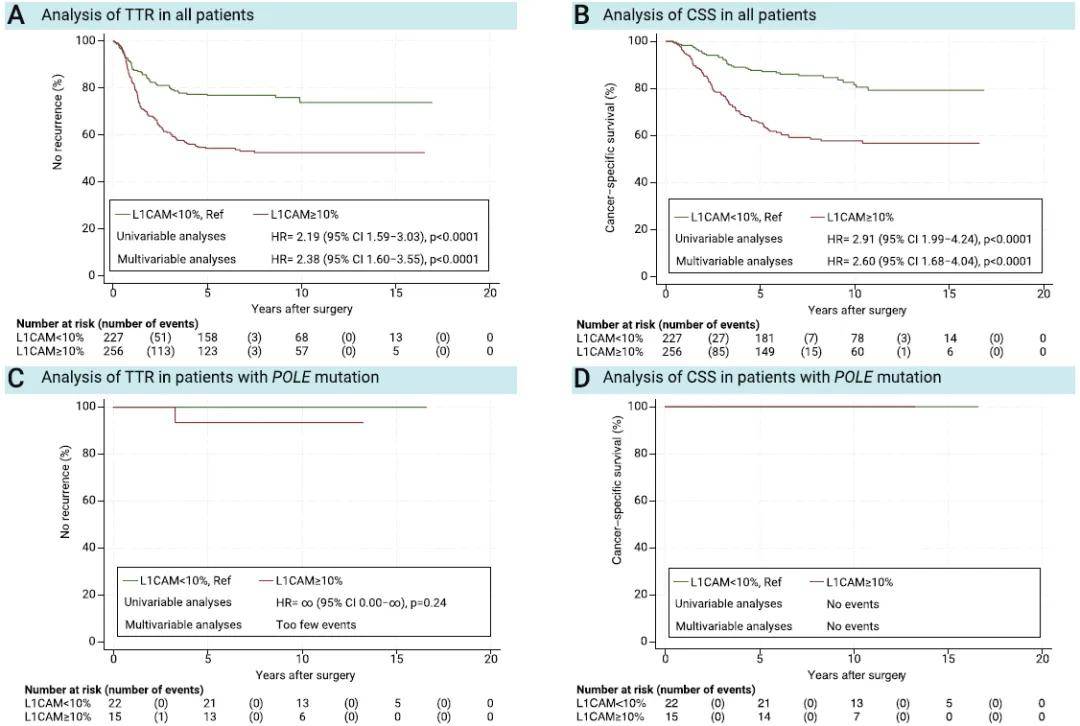
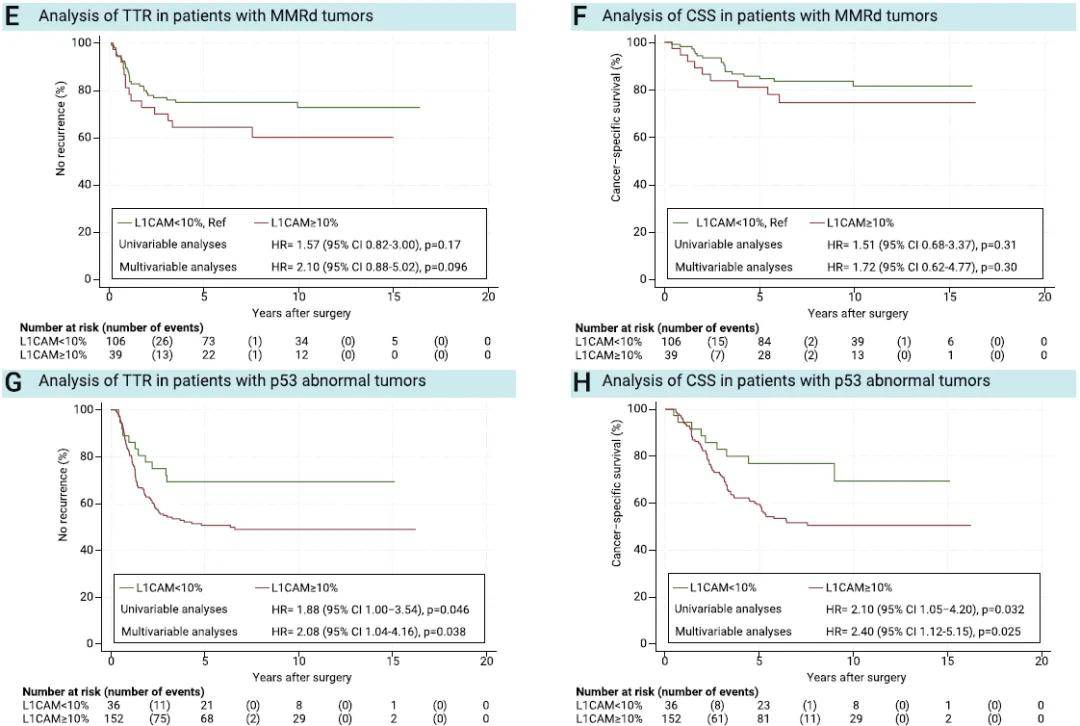
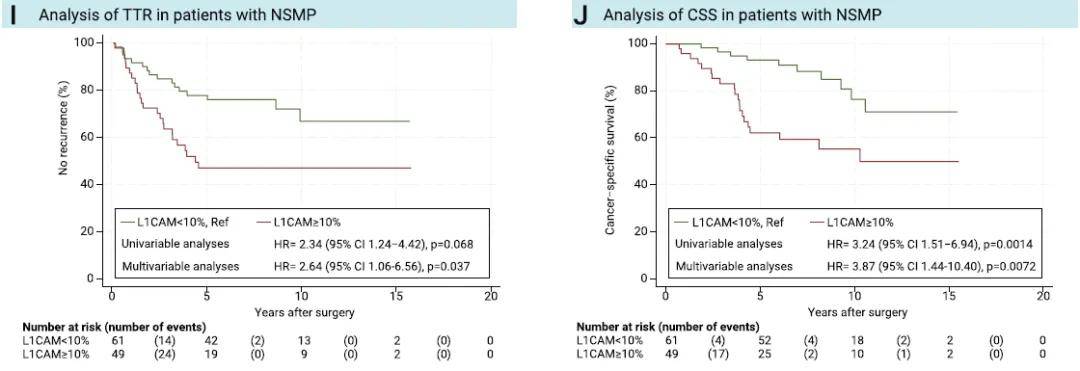

图2

表2
单因素及多因素分析显示,L1CAM高表达的NSMP患者预后与p53异常型患者相近,均较差;而L1CAM低表达的NSMP患者预后则与MMRd患者相似(图1C、D)。本研究尝试调整p53与L1CAM的检测顺序,建立一种新的分子分型流程:首先依据POLE突变状态分型,其次为错配修复状态,再根据L1CAM表达水平分型,最后依据p53异常状态分型。对该替代分型方案进行单因素及多因素分析,结果证实,p53异常且L1CAM低表达的患者,其预后与错配修复功能正常(MMRp)且无POLE突变的患者相似(图1E、F)。
依据机构诊疗指南,大多数Ⅲ期患者接受化疗。具体而言,210例Ⅲ期患者中,173例(82%)接受辅助化疗,仅2例(1%)接受辅助放化疗。279例FIGO Ⅰ/Ⅱ期患者中,85例(30%)未接受辅助治疗,184例(66%)接受辅助化疗,其余10例(4%)接受辅助放疗或放化疗。按ProMisE分子分型亚组分层分析显示,辅助化疗可显著延长MMRd组和p53异常组患者的TTR并改善CSS,且在单因素和多因素分析中均具有统计学意义;但在POLE突变组和NSMP组中,未观察到辅助化疗的获益(图3)。
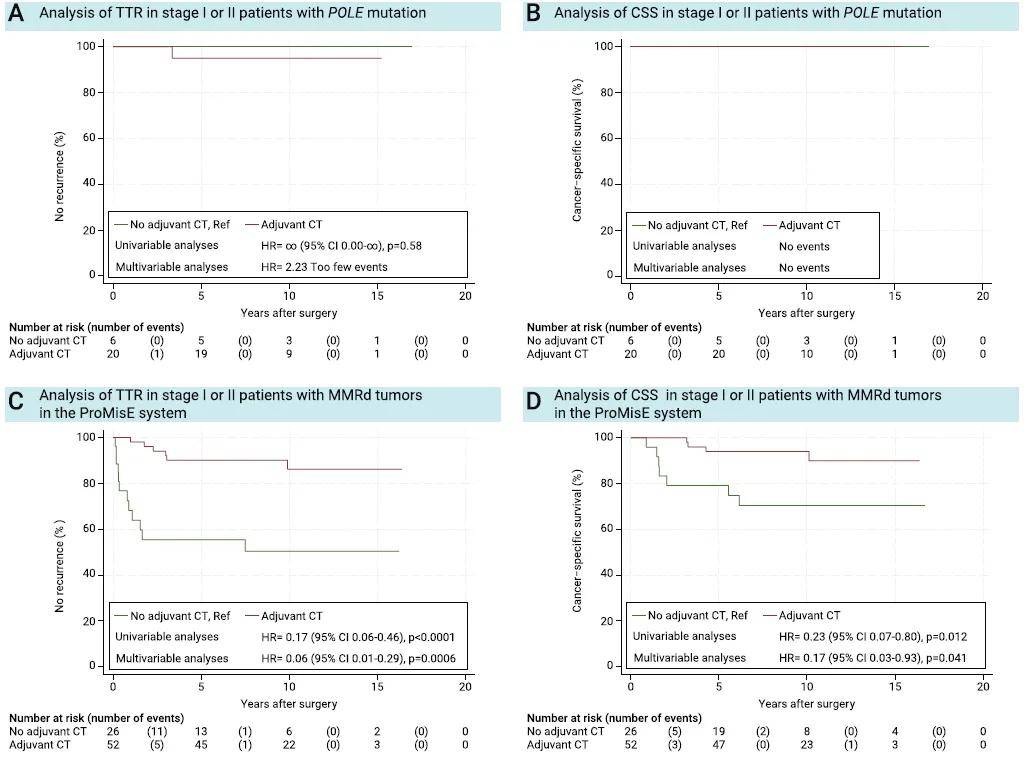

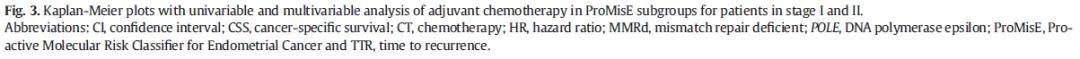
图3
在298例无POLE突变且非MMRd的肿瘤中,p53异常与L1CAM高表达呈显著正相关(P < 0.0001)(表3)。辅助化疗的疗效与L1CAM表达水平无关,L1CAM高表达和低表达患者接受辅助化疗后的风险比(HR)相近。

表3
表3列出了不同ProMisE分子分型亚组及NSMP组中不同L1CAM表达水平患者的172例复发灶的部位及复发率。数据显示,L1CAM高表达患者的远处复发率数值更高,但差异无统计学意义,这也是此类患者预后与p53异常型患者同样较差的原因。
在仅接受化疗且未接受放疗的辅助治疗患者中,357例中有113例(32%)出现复发。所有亚组的局部区域复发率均较低。p53异常组及L1CAM高表达的NSMP组患者远处复发率较高。对于未接受辅助治疗的Ⅰ/Ⅱ期MMRd组和NSMP组患者,远处复发率为10%(5/52),而阴道复发率为29%(15/52)。
讨 论
在这项纳入大样本高危患者的队列研究中,L1CAM表达水平与手术分期、LVSI、手术时年龄、组织学类型及分级、辅助治疗方案、盆腔淋巴结分期清扫术均为强效预后因素。在TTR和CSS的单因素分析中,ProMisE分子分型具有统计学意义;在TTR的多因素分析中,该分型也具有统计学意义,但这一意义仅在模型未纳入L1CAM表达水平时存在。在排除POLE突变型的MMRp肿瘤患者中,研究观察到p53异常与L1CAM高表达呈显著正相关,这与既往研究结果一致。本研究证实,无论在p53异常组还是NSMP组中,L1CAM表达水平均具有独立预后价值。p53异常且L1CAM高表达的患者远处转移发生率为40%,而p53异常且L1CAM低表达的患者远处转移发生率仅为22%。NSMP组中L1CAM高表达的患者占比相对较低,但该表达特征仍与较高的远处复发率相关。已有大量研究证实,L1CAM高表达与盆腔淋巴结转移及远处转移密切相关。本研究队列中患者的盆侧壁复发率较低,这可能与大部分患者均接受了淋巴结分期清扫术有关。远处转移患者预后极差,而阴道/盆腔中央区复发的患者通常可通过放疗实现挽救性治疗,尤其是在初次确诊时不伴高危因素的患者中,放疗疗效更为显著。正是由于L1CAM高表达的肿瘤具有较强的转移潜能,该指标才成为预测TTR缩短及CSS降低的主导因素。
在本研究的高危患者队列中,POLE突变状态与L1CAM表达水平是决定患者预后的核心分子特征;同时研究发现,辅助化疗可为MMRd和p53异常型肿瘤患者带来生存获益。PORTEC 3随机对照研究结果显示,在体外照射放疗(EBRT)基础上联合化疗,可提高p53异常组患者的5年无复发生存率,但对MMRd组和NSMP组患者无显著获益。部分患者群体即便接受了辅助化疗,远处复发率仍居高不下,这提示我们亟需为这类患者开发更有效的全身性辅助治疗方案。携带TP53基因突变的肿瘤常存在同源重组修复缺陷,这为PARP抑制剂用于辅助治疗提供了潜在可能。近年来多项Ⅲ期临床研究证实,免疫治疗对子宫内膜癌患者具有疗效,且该疗效在MMRd型肿瘤中尤为显著。其中两项研究表明,PARP抑制剂联合免疫治疗用于维持治疗具有潜在的协同获益,对p53异常型肿瘤患者的获益可能更为突出。目前,这两种治疗方案均在RAINBO研究中被用于辅助治疗的相关探索。另有研究显示,对于p53野生型肿瘤患者,塞利尼索维持治疗可延长无进展生存期。
Nordic-EORTC-Mango随机对照研究对比了传统体外照射放疗(EBRT)与EBRT联合辅助化疗的疗效,结果显示联合治疗组的CSS显著更优(风险比HR=0.55,95%CI=0.35~0.88,P=0.01)。PORTEC 3研究同样发现,与单纯EBRT相比,放化疗联合治疗可改善患者的无复发生存率,对Ⅲ期患者的获益最为显著。在本研究中,几乎所有Ⅲ期子宫内膜癌患者均接受了化疗。分层分析显示,所有ProMisE分子分型亚组的局部区域复发率均低于10%,这一结果为北欧国家采用的治疗策略提供了依据——即对高危患者可省略辅助放疗,待出现盆腔复发时再行针对性治疗。本研究中各ProMisE分子分型亚组的患者分布比例与其他研究报道的数据相近。同时本研究也验证了既往研究的结论:无论是否存在组织形态学高危因素,POLE突变型肿瘤患者均具有极佳预后。目前,针对POLE突变型肿瘤患者的辅助治疗降阶策略正在相关研究中进行探索。
本研究存在一定局限性,主要源于其回顾性研究设计。研究全程采用多因素分析,以最大程度降低偏倚。此外,本研究未对原始病理诊断进行复核,但所有诊断均由资深妇科病理科医师在初次确诊时完成,因此研究结论更贴合日常临床实践。
L1CAM是高危子宫内膜癌患者的强效预后标志物,在NSMP组中尤为显著。POLE突变型肿瘤患者预后极佳,可在设计严谨的临床试验中纳入观察等待策略的研究范畴。MMRd或p53异常型肿瘤患者可从辅助化疗中获益。接受辅助化疗的患者局部区域复发风险较低,但仍存在较高的远处复发风险,这一现象在p53异常型或L1CAM高表达的患者中更为突出。目前,针对上述子宫内膜癌亚组患者,亟需开发更有效的个体化全身性辅助治疗方案,以满足未被满足的临床需求。
参考文献:
Kleppe, Andreas et al. “Prognostic and therapeutic implication of molecular classification including L1CAM expression in high-risk endometrial cancer.” Gynecologic oncology vol. 192 (2025): 80-88. doi:10.1016/j.ygyno.2024.11.005
