FDA批准乳腺癌新药Poherdy| 一图读懂:2025年11月上半月全球新药研发进展
2025年版第20期《全球药研新动态》
新鲜出炉!
全球新药批准概况
2025年11月上半月,美国食品药品监督管理局(FDA)批准新药申请(NDA)3个,其中包括2个新分子实体(NMEs)。
欧洲药品管理局(EMA)和日本医药品医疗器械综合机构(PMDA)均无批准新药。
数据来源:Pharma ONE药物研发大数据平台,中国医药工业信息中心
全球药品研发概况
2025年11月上半月,全球进入注册前阶段的新药有2个。
数据来源:Pharma ONE药物研发大数据平台,中国医药工业信息中心
全球进入III期临床试验阶段的新药有6个,其中包括3个新化学实体药物(NCEs)。
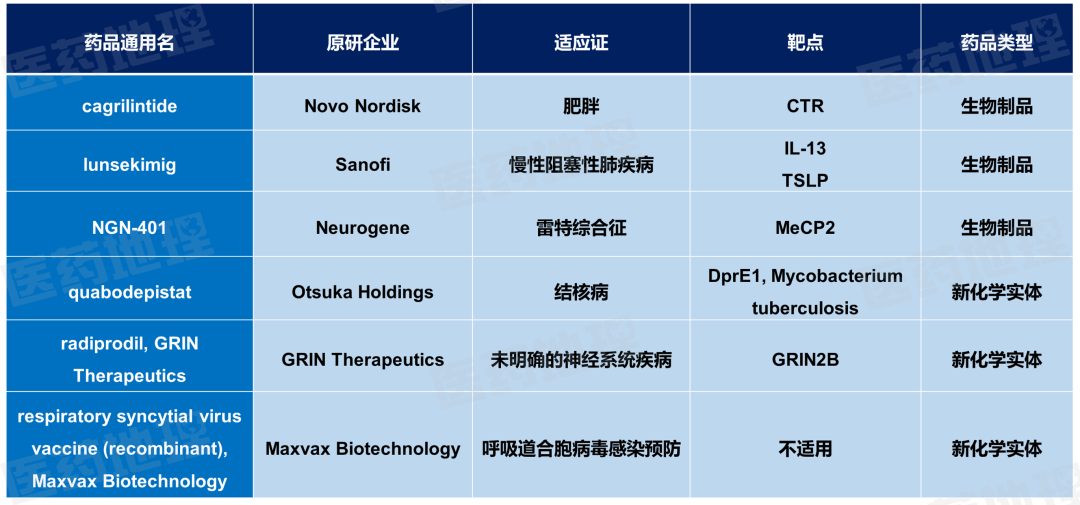
数据来源:Pharma ONE药物研发大数据平台,中国医药工业信息中心
中国药品注册申报概况
2025年11月上半月,国家药品监督管理局药品审评中心(CDE)共受理新注册申请760件(按受理号计,一次性进口申请除外),具体情况如下图。
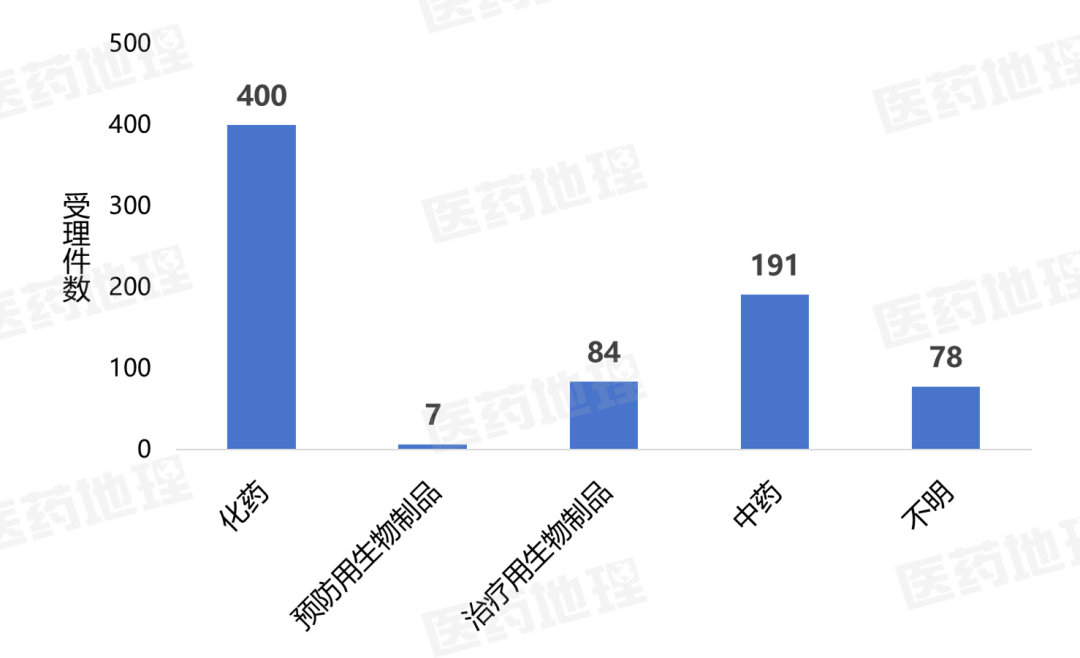
数据来源:Pharma ONE药物研发大数据平台,中国医药工业信息中心
从受理申请类型上看,新药申请100件,仿制申请128件,补充申请385件,进口申请40件,进口再注册29件,其它不明78件。其中,新药申请受理号数量最多为抗肿瘤药,有26个,占比26.0%,内分泌及代谢调节用药也较多,有12个;新药申请剂型主要为注射剂和片剂,分别有44个、27个。
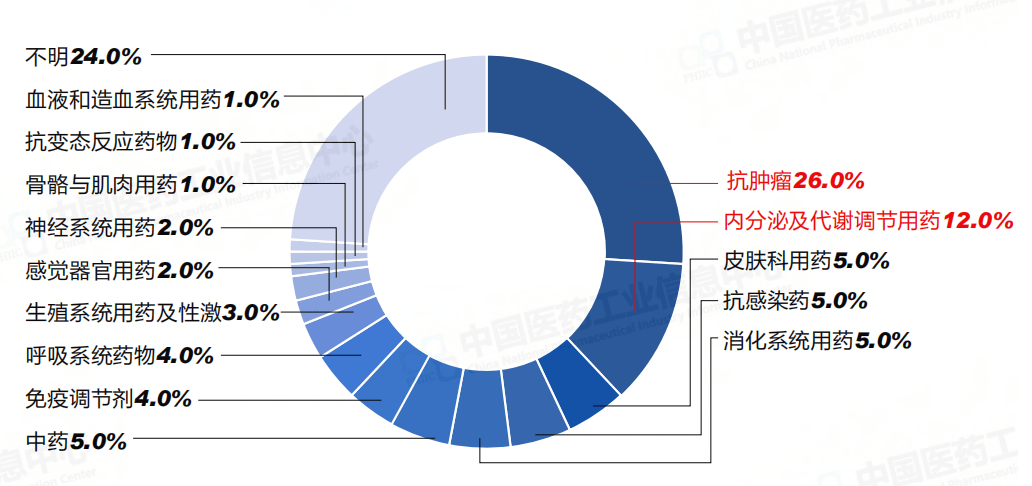
新药申请治疗领域分布(按受理号计)
数据来源:Pharma ONE药物研发大数据平台,中国医药工业信息中心

新药申请剂型分布(按受理号计)
数据来源:Pharma ONE药物研发大数据平台,中国医药工业信息中心
中国药品批准概况
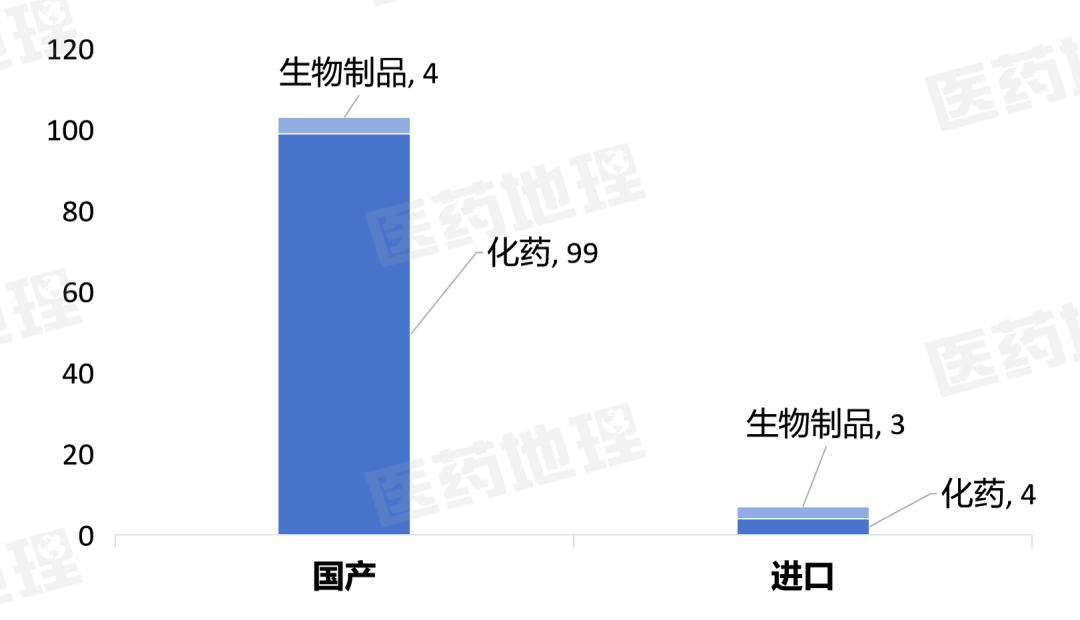
2025年11月上半月,国家药品监督管理局(NMPA)共批准药品上市申请159件。其中,国产药品149件,进口药品10件。
国产药涉及103个品种,其中包括99个化药,4个生物制品。
进口药涉及7个品种,其中包括4个化药、3个生物制品。
数据来源:Pharma ONE药物研发大数据平台,中国医药工业信息中心
