蛋白质组学视角下的中药抗抑郁作用研究进展


抑郁症是一种常见的心理疾病,全球范围内的流行病学数据显示,其发病率逐年上升,已成为导致残疾的重要原因之一。据世界卫生组织的统计,全球大约有2.8亿人患有抑郁症,预计至2030年,将成为全球疾病负担第一的疾病,给个人、家庭和社会带来了巨大的负担[1]。抑郁症不仅影响患者的情绪和生活质量,还与身体健康密切相关,增加了心血管疾病、糖尿病等慢性病的风险[2]。目前治疗抑郁症的药物主要是基于神经递质调节理论的化学药,如5-羟色胺(5-hydroxytryptamine,5-HT)和去甲肾上腺素再摄取抑制剂(文拉法辛等)、选择性5-HT再摄取抑制剂(氟西汀等)、去甲肾上腺素和多巴胺再摄取抑制剂(安非他酮)等,虽然疗效确切,但常伴随恶心、性功能障碍、失眠等不良反应[3]。因此,寻找有效且不良反应小的治疗方法尤为重要。
中药在抑郁症的治疗中有着悠久的历史,传统中医理论认为抑郁症与“气滞”“血瘀”及“阴阳失衡”等因素密切相关[4-5]。近年来,大量临床研究证实中药在抑郁症治疗中的有效性。某些中药方剂如柴胡疏肝散[6]和甘麦大枣汤[7]能够有效改善抑郁症状,并且其不良反应相对较少[8]。现代研究还探讨了中药的多靶点作用机制,包括对神经递质的调节、抗炎作用等[9-11],为中药在抑郁症治疗中的应用提供了科学依据。
随着生物医学研究的进展,蛋白质组学作为一种重要的研究手段,逐渐被用于抑郁症的研究中。通过蛋白质组学技术,可以揭示抑郁症的分子机制,尤其是在探讨中药复方对神经生化系统、肠道微生物和线粒体能量代谢的影响,为中药的作用机制提供新的视角[15]。综上,蛋白质组学在研究中药抗抑郁作用中发挥着重要的作用。本文通过系统分析与抑郁症相关的差异表达蛋白(differentially expressed proteins,DEPs),能够更好地理解中药的作用机制,为临床治疗提供理论支持。这些研究成果不仅为中药在抑郁症治疗中的应用提供了新的思路,也为未来的研究指明了方向。
1 数据与方法
采用中国知网(CNKI)数据库作为中文文献检索平台。CNKI检索方式为“(主题:蛋白质组学+抗抑郁)和(全文:中药)”进行专业检索,时间限定为2015年1月1日—2024年12月30日,选择研究论文,共检索到24篇相关文献;再经过快速浏览文章标题和摘要筛选出10篇中文文献;再使用CNKI检索方式为“(主题:蛋白质组学+抗抑郁)”进行专业检索,时间限定为2015—2024年,只选择研究论文,筛选出额外的1篇中文文献。
英文文献应用PubMed数据库作为文献检索平台,检索方式为“antidepressant”OR“depression”AND“proteomics”AND“traditional Chinese medicine”,时间限定为2015年1月1日—2024年12月30日,共检索到41篇符合条件的英文文献。经过快速浏览文章标题和摘要筛选出20篇英文文献。
2 蛋白质组学技术概述
2.1 基本原理
2.2 发展历程
蛋白质组学技术的发展经历了几个重要阶段。从最初的二维凝胶电泳(two-dimensional gel electrophoresis,2-DE)到现代的质谱分析,其分辨率和灵敏度逐渐升高。2-DE技术通过依据蛋白质的等电点和相对分子质量,将样品依次进行等电点聚焦电泳和十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,再经银染处理,从而获得二维分布的蛋白质电泳图谱。该技术常用于分离和筛选DEPs,若需进一步明确DEPs的具体种类,则需借助质谱技术对蛋白质进行精准鉴定[16]。质谱分析是蛋白质组学中最重要的技术之一,主要分为底层分析法(bottom-up analysis,BU)、顶层分析法(top-down analysis,TD)和中间分析法(middle-out analysis,MD)。BU通过酶解蛋白质为肽段,然后对肽段进行质谱分析,适合大规模样本的定量分析;TD则直接分析完整的蛋白质,适合研究蛋白质的结构和功能;MD通过分析中等大小的蛋白质片段(如大肽或结构域),在通量、覆盖率和信息量之间取得平衡[17]。质谱分析的出现带动了以其为基础的其他检测技术,如同位素标记相对与绝对定量技术(isobaric tags for relative and absolute quantitation,iTRAQ)、靶向蛋白质组学技术等的发展。iTRAQ作为一种高通量筛选技术,通过采用4或8种同位素对蛋白质多肽的氨基末端或赖氨酸侧链基团进行标记,能够实现对样品中蛋白质的高效鉴定与筛选[16]。靶向蛋白质组学技术主要涵盖多重反应监测(multiple reaction monitoring,MRM)和平行反应监测(parallel reaction monitoring,PRM)。其中,MRM通常在三重四极杆质谱仪上实施,分为3个阶段:(1)第1级四极杆质谱筛选出与目标多肽分子质量匹配的母离子;(2)第2级四极杆质谱对母离子进行碰撞诱导碎裂;(3)通过第3级四极杆质谱采集目标子离子的质谱信号。PRM则衍生于MRM,基于混合型质谱仪,构建高分辨率质谱检测平台。PRM通过母离子对每次跃迁进行全扫描,从而实现对所有子离子的同步监测[18]。
近年来,随着生物信息学的发展,数据处理和分析能力的提升,蛋白质组学的应用范围不断扩大,包括癌症研究、代谢疾病和新药研发等领域[14]。
2.3 研究优势
蛋白质组学的研究优势在于其能够提供比基因组学和转录组学更直接的生物学信息。蛋白质是细胞功能的主要执行者,其表达水平和修饰状态直接影响细胞的生理和病理过程。此外,蛋白质组学能够揭示蛋白质间的相互作用网络和信号转导通路,这对于理解复杂疾病的机制至关重要。通过整合多组学数据,蛋白质组学可以为个体化医疗和精准治疗提供更为全面的支持[19-20]。
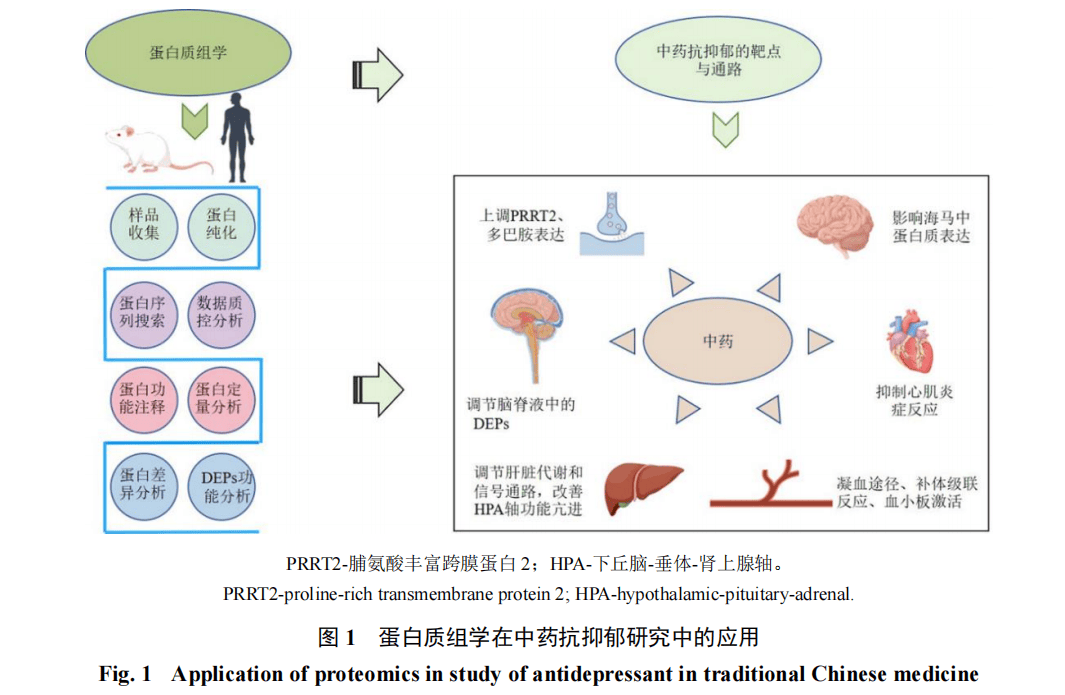
3 蛋白质组学在中药抗抑郁研究中的应用
中药在抑郁症治疗中的效果逐渐受到广泛关注。研究表明,中药能够显著改善抑郁模型大鼠、小鼠的抑郁样行为(图1)。中药可通过调节多种蛋白质表达,影响突触可塑性、神经递质传递、氧化应激反应、神经发育、免疫反应及神经保护等通路,从而发挥抗抑郁作用。
3.1 中药复方及药对
中药复方及药对通过将不同药物组合,可以充分发挥各种药物的协同作用,从而提高治疗效果,在抑郁症的治疗中具有显著优势。但其具体的作用机制仍需进一步阐明,蛋白质组学为揭示中药复方及药对的作用靶点和通路提供了潜在依据。
3.1.1 影响海马突触可塑性调控海马突触可塑性是学习记忆和情绪调节的核心机制,其调控异常与抑郁症等神经精神疾病密切相关。Dong等[21]采用iTRAQ技术研究开心散对慢性温和应激大鼠海马区蛋白质的差异表达情况,共得到33个DEPs,包括7个上调(如真核起始因子4E结合蛋白2等)和26个下调蛋白(髓鞘相关糖蛋白等),进一步通过功能分析表明DEPs参与突触可塑性、神经发生等过程,表明开心散可通过调节关键节点蛋白在突触信号网络中发挥关键作用。Zhang等[22]采用iTRAQ技术进行蛋白质组学分析探讨小柴胡汤对皮质酮诱导的小鼠海马DEPs的影响,共鉴定出DEPs 241个,其中上调蛋白68个,包括细胞周期退出和神经元分化蛋白1等,主要参与神经发生相关的信号通路,通过调节神经前体细胞的增殖和分化,影响海马体的神经发生;下调蛋白173个,其中包括与神经递质合成和释放相关的蛋白(如5-HT1A受体),与细胞凋亡和增殖相关的蛋白(如细胞分裂周期和凋亡调节蛋白1)等,生物信息学分析表明,这些DEPs会导致海马神经发生、神经递质及类固醇激素的调节紊乱。而小柴胡汤可能通过恢复参与信号转导与调控表达的DEPs来发挥其抗抑郁作用。课题组前期应用iTRAQ技术探讨逍遥散对慢性不可预知性温和应激(chronic unpredictable mild stress,CUMS)模型大鼠海马组织蛋白质表达的影响,发现与模型组相比,逍遥散组大鼠海马有28个DEPs,与模型组/对照组鉴定出的DEPs比较,逍遥散回调的DEPs有11个(微管蛋白辅助因子A蛋白、NADH:泛醌氧化还原酶亚基S6等),生物信息学表明DEPs涉及的通路有氧化磷酸化、突触小泡循环、脂质代谢等,该研究为逍遥散调控DEPs发挥抗抑郁作用提供了潜在依据[23]。Chen等[24]采用串联同位素标记技术(tandem mass tag,TMT)结合液相色谱-串联质谱技术进行蛋白质组学分析CUMS模型组和柴胡-白芍处理组的大鼠肝脏组织样本,与对照组比较,CUMS模型组DEPs共37个,其中上调25个(包括细胞色素P450 4A14、类固醇硫酸酯酶、金属硫蛋白-1等),下调12个(包括细胞周期蛋白依赖性激酶、泛素羧基末端水解酶-1、αB-晶体蛋白等);与CUMS模型组相比,柴胡-白芍联合组共鉴定出140个DEPs,其中上调106个(包括细胞周期蛋白依赖性激酶、泛素羧基末端水解酶-1、αB-晶体蛋白等),下调34个(包括磷酸烯醇式丙酮酸羧激酶、神经营养因子-3受体、金属硫蛋白-1等),这些蛋白分别涉及氧化应激反应、细胞周期调控、免疫反应和神经保护等方面。进一步采用Western blotting验证金属硫蛋白-1、细胞周期蛋白依赖性激酶、泛素羧基末端水解酶-1、αB-晶体蛋白表达,结果与蛋白质组学结果一致,表明柴胡-白芍药对可通过调节氧化应激反应、神经可塑性、免疫反应和神经保护等途径来发挥其抗抑郁作用。综上,应用iTRAQ技术寻找DEPs,发现中药复方及其药对可通过影响海马突触可塑性调控调节发挥抗抑郁作用。
3.1.2 影响神经递质系统调节神经递质系统的调节是抑郁症等精神疾病治疗的核心靶点。中药复方抗抑郁活性成分和蛋白质组学研究中发现的DEPs可通过多靶点协同调控神经递质系统的合成、释放、受体信号及代谢清除。Zhu等[25]采用TMT标记结合液相色谱-串联质谱技术,探究柴胡疏肝散对CUMS大鼠海马区的蛋白质组学特征,蛋白质组学数据表明柴胡疏肝散共调控了110个DEPs,且谷氨酸脱羧酶-2和囊泡相关膜蛋白-2是该网络的关键靶点。并整合生物信息学分析对CUMS模型组和柴胡疏肝散处理组大鼠海马组织进行分析,发现柴胡疏肝散可能通过调节γ氨基丁酸和谷氨酸释放途径等信号通路来发挥抗抑郁作用。戴国梁等[26]应用iTRAQ和PRM定量蛋白质组学技术分析交泰丸CUMS大鼠海马组织的影响,与对照组相比,模型组大鼠海马组织中共鉴定出65个DEPs,其中40个上调[蛋白磷酸酶2A的脑特异性调节亚单位(brain-specific regulatory subunit of protein phosphatase 2A,Ppp2r2b)、神经酰胺合成酶1(ceramide synthase 1,Cers1)等],25个下调[泛醌氧化还原酶黄素蛋白3(NADH dehydrogenase oxidoreductase flavoprotein 3,Ndufv3)等];与模型组相比,交泰丸组大鼠海马组织中共鉴定出35个DEPs,其中14个上调(Ndufv3等),21个下调(Ppp2r2b、Cers1等),采用Western blotting对Ppp2r2b、Cers1、Ndufv3关键蛋白进行验证,结果与蛋白质组学结果一致,表明交泰丸可通过影响Ppp2r2b、Cers1、Ndufv3等蛋白水平,调控鞘脂信号通路、腺苷酸活化蛋白激酶(adenosine monophosphate activated protein kinase,AMPK)信号通路及多巴胺能突触等发挥抗抑郁作用。刘世钰[27]应用iTRAQ技术研究养心氏片对血管性抑郁小鼠海马组织蛋白质表达的影响,通过模型组与假手术组和养心氏片治疗组筛选对比,鉴定出400个DEPs,其中246个DEPs上调[包括神经肽Y(neuropeptide Y,NPY)、钙调蛋白依赖性蛋白激酶Ⅱα(calcium/calmodulin-dependent protein kinase IIα,CaMKⅡα)、人神经营养性酪氨酸激酶2型受体(neurotrophic tyrosine kinase receptor type 2,Ntrk2)、胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)等],154个DEPs下调[包括CaMKⅡβ、钠依赖性和氯依赖性γ-氨基丁酸转运体1(sodium and chloride dependent gamma aminobutyric acid transporter 1,GAT1)、GAT3等],采用qPCR验证NPY、CaMKⅡα、Ntrk2、GFAP、CaMKⅡβ、GAT1、GAT3的mRNA水平,结果与蛋白质组学结果一致,表明养心氏片可通过影响Ca2+相关信号通路传递、兴奋性神经递质的转运和释放、神经可塑性调节,氨基酸、能量的代谢等过程治疗抑郁症。综上,表明中药复方可通过调节DEPs表达影响神经递质系统调节发挥抗抑郁作用。
3.1.3 影响代谢与炎症调控代谢与炎症调控之间存在复杂的相互作用网络,二者通过多种分子机制相互影响,共同参与抑郁症的病理过程。谭婧萱[28]采用iTRAQ技术探讨柴胡疏肝散对CUMS大鼠肝脏组织蛋白的影响,发现柴胡疏肝散给药组与模型组之间鉴定出204个DEPs,对其进行基因本体(gene ontology,GO)功能富集和京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路富集发现,柴胡疏肝散主要通过调控糖脂代谢和能量代谢发挥抗抑郁作用。温小雨等[29]采用蛋白质组学和网络药理学技术探讨加味逍遥散对肝癌并发抑郁大鼠的潜在机制,发现加味逍遥散可同时调控谷胱甘肽硫转移酶M1(glutathione S-transferase M1,GSTM1)、3磷酸肌醇依赖性蛋白激酶1(3-phosphoinositide-dependent protein kinase 1,PDK1)、热休克蛋白90AB1(heat shock protein 90αfamily class B member 1,HSP90AB1)3个蛋白靶点,表明加味逍遥散可能通过影响GSTM1、PDK1、HSP90AB1表达纠正大鼠抑郁样行为,改善肝脏形态等作用发挥治疗肝癌并发抑郁症的作用。Huang等[30]采用TMT标记结合PRM验证的蛋白质组学技术建立评估逍遥散对CUMS小鼠模型的疗效,通过对小鼠脑组织、血清样本分析,发现逍遥散可通过调节髓系来源生长因子/丝裂原激活蛋白激酶4/核因子-κB信号通路,减轻CUMS小鼠的炎症反应和抑郁样行为。综上,采用蛋白质组学技术(如iTRAQ、TMT)结合网络药理学等生物信息学技术,可为揭示中药复方调节代谢和炎症通路改善抑郁症状的机制提供潜在依据。
中药复方通过蛋白质组学技术揭示了其多成分、多靶点、多通路的协同作用机制。研究表明,复方可通过调控DEPs表达,影响神经递质水平,进而调控相关信号通路,共同构成了复方整体疗效的分子基础,凸显了中药复方“整体调节、协同起效”的治疗优势;同时中药复方可作用于神经可塑性、代谢、炎症等多维度病理环节;中药复方涉及通路交叉,脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)、丝裂原活化蛋白激酶、AMPK等关键通路被多复方共同调控。
此外,以疏肝解郁、调畅情志为主的部分中药经典名方及一些经验组方在多药物协调的作用下也可以发挥抗抑郁的作用。如加味四逆散[31]、舒心方[32]、二仙汤[33]、复合中药提取物(赤芍、栀子、合欢皮、牡丹皮)[34]、开郁至神汤[35]、化浊解毒疏肝方[36]、加味丹栀逍遥散[37]、温胆汤[38]、参栀灵[39]、解毒通络颗粒[40]等。
3.2单味药
贯叶连翘作为西方广泛使用的抗抑郁中药,具有临床疗效好,患者依从性高等特点,在临床中具有良好的应用前景。谭婧萱[28]采用iTRAQ技术探讨贯叶连翘对CUMS大鼠肝脏组织蛋白的影响,发现贯叶连翘给药组与模型组之间鉴定出473个DEPs,对其进行GO和KEGG富集发现,贯叶连翘可能通过调控炎症信号通路、脂质代谢、氨基酸代谢等影响神经递质水平,进而发挥抗抑郁作用。
此外,柴胡(疏肝解郁)[41]、远志(安神益智、交通心肾)[42]、甘草(补脾益气)[43]等单味药均可通过不同途径改善抑郁状态,进而达到抗抑郁的效果。
3.3中药单体
中药单体即从传统中药中提取的单一活性成分,在抑郁症的治疗中显示出较高的有效性。Guo等[44]通过研究柴胡皂苷A对CUMS模型大鼠的影响,对各组大鼠海马组织样本进行蛋白质组学分析,鉴定出15个共有DEPs,包括PRRT2、副肿瘤性抗原MA2、Copine家族蛋白7等,其中PRRT2为关键差异蛋白,表明柴胡皂苷A可能通过调节PRRT2表达和多巴胺含量来缓解CUMS大鼠的抑郁症状。张腾[45]通过研究大黄素对慢性应激诱导大鼠的海马组织的影响,发现大黄素可通过增强抗氧化能力,减少海马组织中的氧化应激和炎症反应减轻慢性应激诱导的大鼠抑郁样行为。
TMT相对定量蛋白质组学技术在中药单体揭示治疗抑郁症机制也做出了广泛的贡献。Zeng等[46]通过研究淫羊藿苷对CUMS模型大鼠脑脊液的影响,共鉴定出52个共有DEPs,包括核糖体蛋白S4 X-连锁、HSP90b1、HtrA丝氨酸蛋白酶1等,这些蛋白主要涉及核糖体、磷脂酰肌醇3-激酶/蛋白激酶B信号通路和白细胞介素-17等信号通路,表明淫羊藿苷可能通过调节脑脊液中的关键蛋白来缓解抑郁症状和改善海马神经发生。牟翔宇[47]通过研究柴胡皂苷和芍药苷(柴芍皂苷)对经前情绪障碍症(premenstrual dysphoric disorder,PMDD)肝气郁证模型大鼠海马脑区的影响,发现模型组下调、柴芍皂苷给药组上调且功能明确的DEPs有内质网降解增强子3、Ras相关GTP结合蛋白A、钾大电导钙激活通道亚基α1、血小板反应蛋白1结构域包含蛋白7B等;而模型组上调、柴芍皂苷给药组下调且功能明确的DEPs有EARP复合物相互作用蛋白1、蛋白激酶A催化亚基α(protein kinase A catalytic subunit α,Prkaca)、血红蛋白α亚基A3、酪氨酸3-单加氧酶/色氨酸5-单加氧酶激活蛋白η(tyrosine 3-monooxygenase/tryptophan 5-monooxygenase activation protein η,Ywhah)等,表明PMDD肝气郁证的发病机制可能与海马脑区中Ywhah及Prkaca等蛋白的表达相关。Zhang等[48]通过研究黄芩苷对皮质酮诱导的抑郁模型组小鼠下丘脑组织样本的影响,发现黄芩苷处理后,共鉴定出370个DEPs,其中上调114个,下调256个,通过GO富集发现DEPs主要参与磷酸化、磷脂酰丝氨酸结合和糖皮质激素受体介导的信号通路,表明黄芩素能够恢复皮质酮诱导的糖皮质激素受体磷酸化异常,从而发挥抗抑郁作用。Zhou等[49]通过研究百合鳞茎多糖对源于卵巢切除术和CUMS模型小鼠前额叶皮层组织样本的影响,发现百合鳞茎多糖可能通过保护神经递质、神经营养因子和雌激素受体β来缓解更年期相关的精神症状。Liu等[50]通过研究木犀草素对晚发型抑郁样(late-onset depression,LOD)大鼠模型脑脊液的影响,发现113个蛋白被认为是木犀草素治疗LOD的DEPs,包括Eph受体A5配体、EPH受体B4、EPH受体A4、信号素-7A、神经轴突导向因子G1等,这些关键蛋白主要属于轴突引导分子家族,表明木犀草素可能通过调节轴突导向通路相关分子,改善LOD大鼠的认知和抑郁样行为。
4 未来研究方向与挑战
4.1 蛋白质组学技术的发展
4.2 蛋白质组学与其他组学技术的结合
蛋白质组学与其他组学技术的结合为生物医学研究提供了更为全面的视角。通过将蛋白质组学与基因组学、转录组学和代谢组学等技术相结合,能够更深入地理解生物系统的复杂性。如Burtscher等[53]通过热蛋白质组学技术与转录组学结合,发现聚ADP核糖聚合酶抑制剂通过激活Hippo信号通路,进而抑制卵巢癌细胞增殖,提示Hippo信号通路可能成为肿瘤治疗的新靶点。此外,随着人工智能和机器学习技术的发展,数据整合和分析的能力得到显著提升,为多组学数据的综合分析提供了新的可能性[54]。未来的研究应致力于开发新的整合分析工具,以便更好地解析复杂生物体系中的相互作用和动态变化,从而推动个性化医疗的进展。
5 结语
蛋白质组学作为一种重要的研究工具,在探索中药作用机制及其临床应用潜力方面发挥重要作用。通过对抑郁症相关蛋白质的系统分析,能够揭示中药成分如何影响神经生物学途径,从而为抑郁症的治疗提供新的理论基础与实践指导。中药在抑郁症治疗中的独特优势在于其多靶点的作用机制,能够同时调节多条生物途径,这与现代药物往往是单一靶点的策略形成鲜明对比。
随着蛋白质组学在中医药抗抑郁研究广泛应用,其缺陷也随之体现,主要表现为(1)复杂系统检测难,难以全面捕捉中药多成分、多靶点、低丰度蛋白修饰的复杂网络;(2)样本异质与标准化,证型异质性及样本处理缺乏标准,增加分析复杂性,降低数据可比性;(3)数据整合与验证弱,多组学联合分析技术不成熟;差异蛋白与中药成分中医理论关联缺乏系统性验证;(4)模型转化与样本限制,动物模型蛋白质组与人类存在差距;临床脑组织难获取,外周样本反映中枢机制存疑;(5)中医药特有挑战,复方协同作用机制不明;“郁证”蛋白质组特征未建立,中西医分型对接困难。总之,蛋白质组学在中医药抗抑郁研究中需进一步解决技术瓶颈、标准化问题等难题。
因此,蛋白质组学在中药抗抑郁研究中的应用潜力巨大。随着技术的不断进步,结合多组学数据(如转录组学、代谢组学等),为深入理解中药的复杂作用提供更加全面的视角。此外,加强基础研究与临床实践的结合,将为中药在抑郁症治疗中的应用开辟新的路径。总之,蛋白质组学在中药抗抑郁研究中扮演着不可或缺的角色,通过整合不同研究的成果与观点,未来我们有望进一步推动中药的科学化发展,为抑郁症患者提供更加有效的治疗选择。
上一篇:探访广西防城港 传统渔村焕新颜
