疾病控制率达93%!“癌王”新疗法发布最新临床数据
2026年1月8日至10日,一年一度的美国临床肿瘤学会胃肠肿瘤研讨会(ASCO GI),在美国旧金山莫斯康会展中心如期举行。作为全球顶级的胃肠道肿瘤学术会议,ASCO GI一直被视为胃肠道肿瘤领域的研发风向标。
在第二日的议程中,一项针对转移性胰腺导管腺癌(mPDAC)临床研究数据首次公开发表,引发了广泛关注。这项研究围绕创新药企Phanes Therapeutics自研的CLDN18.2&CD47双抗新药spevatamig展开。虽然只是临床概念验证阶段的数据,spevatamig却展示出了对抗“癌王”胰腺癌的巨大潜力。
在联合经典化疗方案用于一线治疗mPDAC的过程中,spevatamig在安全可控的前提下,极大提升了患者的疾病控制率,延长生存期。更重要的是,spevatamig将有“被诅咒的靶点”之称的CD47药物开发往前推了一步,患者治疗期间没有观察到严重的贫血、中性粒细胞减少症或血小板减少症。而此前,严重的血液毒性,曾成为不少CD47明星管线临床开发的滑铁卢。
01
“癌王”新药被验证
现阶段,TWINPEAK正在进行II期联合扩展和剂量优化研究。其中,联合扩展队列包括与化疗和/或免疫检查点抑制剂的联合治疗。截至2025年12月12日,已经有107例消化道肿瘤患者在美国接受了spevatamig的单药或联合治疗。
长期以来,胰腺癌被视为癌中之王,治疗手段极其有限,患者五年生存率不及5%。一旦确诊胰腺癌,大多患者只能接受全身化疗。由于癌症产生耐药性和累积毒性,化疗仅能带来短暂获益。即便是在创新的免疫疗法广泛进入临床后,“癌王”的治疗困境也没能改善。这是因为,常见的PD-1抑制剂、CTLA-4抑制剂等,属于靶向“适应性免疫系统”的方法,难以对抗mPDAC这类“冷”肿瘤,并且严重不良反应和剂量限制性毒性发生率高。迄今为止,尚无免疫疗法或生物制剂被批准用于mPDAC患者的一线治疗。
临床上,吉西他滨联合白蛋白紫杉醇(GnP方案),是治疗mPDAC的主流化疗方案。在TWINPEAK研究的联合治疗队列中,42例患者接受了spevatamig联合GnP的多种剂量方案的一线治疗。在此次ASCO GI上,Phanes Therapeutics主要展示2 mg/kg spevatamig每周一次给药联合GnP剂量方案的数据。
数据显示,在2 mg/kg spevatamig每周一次给药联合GnP一线治疗mPDAC的15例患者中(n=15),有6例患者达到部分缓解(其中5例已确认,1例待确认)、8例患者疾病稳定,疾病控制率为93%(对比关键临床研究中的48%),客观缓解率为40%。

值得注意的是,在这个剂量方案的研究中,Phanes Therapeutics选择了与两项GnP关键临床研究MPACT研究、NAPOLI-3研究疾病相同、基线特征相似的患者,便于直接对比两种治疗方案的疗效。数据显示,相比MPACT研究和NAPOLI-3研究中的GnP治疗组,本研究中患者的中位无进展生存期由5.5个月和5.6个月,提升至7.3个月,中位总生存期由8.5个月和9.2个月提升至13.2个月。同时,受试患者6个月无进展生存率、6个月总生存率,也由MPACT研究GnP治疗组的44%和67%,大幅提升至59%和93%。
换言之,在衡量肿瘤治疗效果的主要和次要指标上,spevatamig联合GnP的方案均相比现有的化疗方案有了明显的改善。与此同时,研究者在TWINPEAK研究中观察到了良好的安全性表现,这一点将在后文具体展开。对于确诊后生命以月计算的胰腺癌患者而言,一款可能让总生存期较现有化疗延长近一半的药物,意义不可谓不重大。
目前,spevatamig正处于美国II期与中国II期临床阶段,是全球同靶点药物中,临床进度最快的管线。此外,spevatamig的胰腺癌适应症已经进入了FDA的快速审批通道。2022年6月,spevatamig获FDA胰腺癌孤儿药资格,2年后又获转移性Claudin18.2阳性胰腺癌快速通道资格。此番公布的TWINPEAK研究阶段性数据,是spevatamig走向临床应用的关键一步。
02
源头上的结构优化
Spevatamig能够相对安全地控制胰腺癌进展,主要得益于其独特的结构设计。
在靶点选择上,spevatamig的两个抗体单臂分别靶向CLDN18.2和CD47。在mPDAC患者的肿瘤细胞上,CLDN18.2和CD47均过表达,这使它们成为该疾病有前景的治疗靶点。尤其是可以激活“先天免疫系统”的CD47靶点,在理论上具有强大的疗效和临床前景。
不过,CD47靶向药物一直饱受血液副作用的限制。2024年,受制于严重的副作用,吉利德被迫放弃了斥重金开发的CD47明星管线magrolimab。数据显示,在magrolimab组患者中,有76.4%经历了与研究药物相关的3级或以上不良事件,包括中性粒细胞减少症、贫血、血小板减少症等血液毒性,远高于对照组56.4%不良事件的不良事件率。被遗弃magrolimab,成为CD47药物开发史上的经典转折。
同时,另一个靶点CLDN18.2在胃黏膜表达,导致当CLDN18.2靶向药物与之结合时会引起恶心和呕吐。因此,靶向CLDN18.2和CD47作为抗癌治疗,需要一种能够减轻或解决与CLDN18.2相关的胃肠道毒性,以及与CD47相关的血液毒性的策略。
相比传统的双抗药物,spevatamig经过了双重分子设计。
一方面,在抗CD47单克隆抗体的选择上,Phanes Therapeutics使用了三种具有不同生物学特征的抗CD47单克隆抗体,即与magrolimab类似的PT248、与lemzoparlimab类似的PT246和与众不同的PT240。
通过系统探索CD47生物学,Phanes Therapeutics选择了PT240。CD47药物的高血液毒性,主要是由于CD47在红细胞、血小板和中性粒细胞上的表达,这些细胞会被CD47靶向药物激活的单核细胞/巨噬细胞迅速清除。而PT240与肿瘤细胞结合程度高,与红细胞结合程度小,成为减少血液毒性的关键。
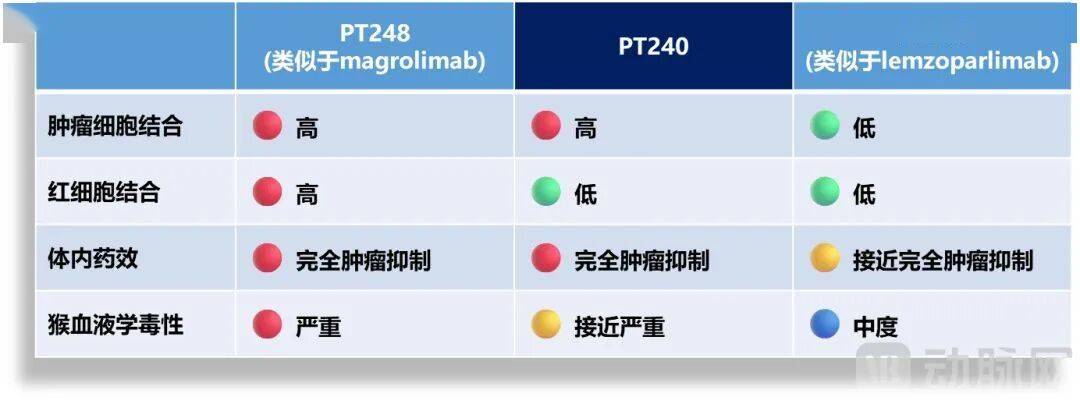
另一方面,利用PACbody®和SPECpair®双特异性抗体技术平台,Phanes Therapeutics使用来自PT240的抗CD47单臂和抗CLDN18.2抗体的单臂,在IgG1骨架基础上,构建了双特异性抗体spevatamig。
与通常具有两个抗CLDN18.2单臂的许多CLDN18.2靶向药物不同,spevatamig只有一个抗CLDN18.2单臂,这使其对不表达CD47的胃黏膜的结合较弱,从而可能减少恶心和呕吐。同理,spevatamig只有一个抗CD47单臂,这使其对不表达CLDN18.2的红细胞的结合也较弱。因此,spevatamig通过其两个单臂与癌细胞的高结合能力,在发挥潜在疗效作用的同时,限制了非肿瘤靶向(胃肠道)毒性。
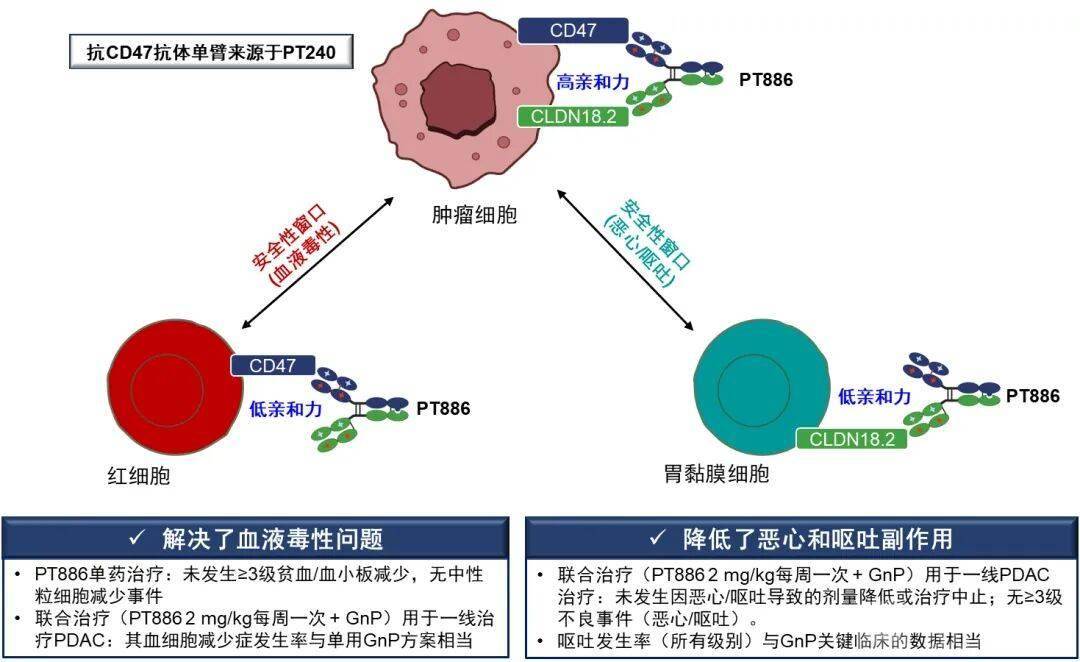
目前,spevatamig设计的临床概念已经得到了数据验证。在TWINPEAK研究纳入的107例患者中,单药治疗组未观察到细胞因子释放综合征或剂量限制性毒性。现阶段,spevatamig在单药或联合治疗中均未达到最大耐受剂量,单药治疗组在研究期间未观察到≥3级贫血、中性粒细胞减少症或血小板减少症治疗期间不良事件(TEAE)。
其中,在2 mg/kg spevatamig每周一次给药联合GnP剂量水平,贫血、中性粒细胞减少症和血小板减少症的发生率与关键临床试验中GnP治疗组观察到的发生率相当。未发生≥3级的治疗期间的恶心或呕吐事件,也未发生因恶心或呕吐导致的剂量降低或治疗中止。未观察到细胞因子释放综合征。这些临床概念验证数据表明,spevatamig的分子设计减轻了血液毒性并改善了胃肠道耐受性。
目前,>2 mg/kg spevatamig每周一次给药联合GnP的疗效数据正在成熟,将揭示更高剂量的spevatamig是否可能为mPDAC患者带来更大的临床获益。
尽管只是小样本的临床研究,尚不具备统计学上的稳定性,在临床概念验证中的出色表现,让spevatamig后续的大规模临床试验更值得期待。
03
风浪中的CD47靶点或将破局
在肿瘤免疫药物的开发史上,CD47是一个颇有戏剧性的存在。
通常,肿瘤免疫疗法的逻辑,包括激活T细胞来对抗肿瘤的适应性免疫,和激活巨噬细胞来对抗肿瘤的先天免疫。目前,针对适应性免疫的代表性靶点PD-1,已经有大量药物投入临床应用;而针对先天免疫的代表性靶点CD47,药物开发却深陷泥潭。
理论上,CD47药物是比大众熟悉的PD-1抑制剂更强的肿瘤免疫药,因为前者可以激活先天免疫和适应性免疫双重抗癌机制,后者则只依靠适应性免疫。此外,CD47在细胞表面广泛表达,理论上讲,靶向CD47的免疫药物在肿瘤患者中的应答率也会更高。
2020年前后,CD47靶点这种更强大的肿瘤免疫逻辑,吸引了大批制药企业踊跃开发新药,其中不乏吉利德、辉瑞等跨国药企。据弗若斯特沙利文统计,全球有超60个以CD47为靶点的在研新药管线。预计到2030年,全球CD47/SIRPα靶向疗法市场规模将达126亿美元。
2020年3月,吉利德以49亿美元收购Forty Seven,将明星资产为CD47单抗magrolimab收入囊中,这是CD47领域迄今为止金额最大的收购案。彼时,magrolimab 联合阿扎胞苷用于治疗急性髓系白血病的I/II期数据显示,客观缓解率达到64%,瞬间点燃行业的开发热情。同年9月,艾伯维与国内Biotech天境生物达成合作,以1.8亿美元首付款和2000万美元里程碑付款的对价,获得天境生物CD47靶点药物lemzoparlimab的部分权益。
CD47领域的另一起著名收购案发生在吉利德交易的次年。2021年11月,辉瑞以22.6亿美元收购Trillium Therapeutics,获得两款CD47靶向药物maplirpacept和ontorpacept。其中,maplirpacept为IgG4的Fc区域与SIRPα的融合蛋白药物,ontorpacept为IgG1的Fc区域与SIRPα的融合蛋白药物,曾在淋巴瘤、多发性骨髓瘤的I/II期临床研究中,显示可控的安全性与初步疗效。
在这期间,风险投资机构也纷纷下场,试图抢占CD47赛道的先机。比较具有代表性的交易包括高瓴资本自C轮后多次加码信达生物,为其CD47管线IBI188的临床前研究和IND申报提供资金支持。根据动脉橙数据库,自2020年以来,有超100亿一级市场资金流入与CD47靶点相关的创新药项目。
随后,CD47开发的坏消息却接踵而至。除了前文提到的吉利德全面放弃magrolimab的开发外,2023年9月,天境生物与艾伯维的合作协议终止,宣告了两家公司在CD47靶点开发药物的失败。2025年6月,辉瑞宣布maplirpacept治疗复发/难治性弥漫性大B细胞淋巴瘤的II期研究因患者招募困难终止,此前ontorpacept已悄然从管线中消失。
当然,制药界并没有完全放弃CD47靶点。基于分子结构优化、肿瘤微环境激活、靶点协同等思路,CD47管线不断被优化。眼下,开发第二代,甚至第三代CD47管线,成了新的热潮。不过,这些优化措施大多处于早期验证阶段。
而spevatamig率先公布的临床概念验证数据显示,通过显著降低血液不良事件,靶向CD47先天免疫治疗mPDAC的探索被推向了关键里程碑。Spevatamig也有潜力成为首个针对实体瘤适应症的先天免疫靶向药物。
从某种意义上讲,spevatamig不止为胰腺癌患者提供了一个新的治疗选择,更代表了一种研发思路的有效验证,即通过顶尖的抗体工程学智慧,将生物学上已知的“致命诱惑”,转化为临床上“安全有效”的利器。
04
写在最后
在ASCO GI上,Phanes Therapeutics还提到一个几乎被忽略的数据,spevatamig对CLDN18.2靶点表达水平只需要10%,远低于许多其他CLDN18.2靶向疗法的要求。这意味着,spevatamig可覆盖潜在约85%的mPDAC患者。对于晚期肿瘤患者而言,药物的广谱有效性,至关重要。
此外,作为一种免疫疗法,spevatamig的可联合性和差异化的作用机制、卓越的安全性,使其不单能作为现有标准化疗的“增效器”,更可能成为未来靶向与免疫联合疗法的核心枢纽,成为更多肿瘤创新治疗方案(如KRAS抑制剂)的理想搭档。
从更长远的视角看,一款具有平台属性的抗肿瘤药物,可能成为改变治疗思路的基石。
如果您想对接文章中提到的项目,或您的项目想被动脉网报道,或者发布融资新闻,请与我们联系;也可加入动脉网行业社群,结交更多志同道合的好友。
近
期
推
荐
声明:动脉网所刊载内容之知识产权为动脉网及相关权利人专属所有或持有。未经许可,禁止进行转载、摘编、复制及建立镜像等任何使用。文中如果涉及企业信息和数据,均由受访者向分析师提供并确认。
动脉网,未来医疗服务平台
