首都医科大学:压力诱导产生的甲醛是导致抑郁的关键!
脑悦康数字化健康平台,基于南加州大学梁京院士28年研究,系统提升睡眠、情绪与记忆力。服务10万余众,现提供免费专项评估与个性化解读,开启您的科学健康管理。
前言
抑郁症是全球致残的主要疾病之一,传统理论聚焦于单胺类神经递质不足假说。然而,2025年发表于《Molecular Psychiatry》的一项开创性研究首次揭示,压力衍生的内源性甲醛(FA)可能是连接压力应激与抑郁症的关键分子桥梁。该研究通过整合小鼠模型、人类临床数据和多组学分析,证实急慢性压力可诱导海马CA1区FA生成,进而通过使单胺类神经递质(5-HT、DA、MT)失活和损伤神经元兴奋性,触发抑郁样行为。这一发现为理解抑郁症的病理生理机制提供了新视角,并为治疗策略开发提供了新靶点。

一、 实验设计:多维度验证FA的抑郁触发作用
通过多模型整合与尖端技术平台,研究构建了FA抑郁作用的系统性验证体系。
模型系统构建:研究采用急慢性压力模型(CUMS)、FA海马微量注射模型及人类青少年抑郁症队列,结合行为学测试、电生理记录、分子检测和影像学分析。
技术平台整合:
- FA检测:使用FA敏感性荧光探针(NaFA)实时监测活体FA动态
- 电生理记录:膜片钳技术记录海马CA1区神经元放电活动
- 分子互作验证:GC-MS/MS分析FA与单胺类神经递质的化学反应
- 临床验证:MRI量化青少年MDD患者海马CA1萎缩,ELISA检测血液FA水平
- 统计分析严谨:Meta分析整合环境压力、基因多态性与FA代谢关联,Spearman相关分析FA水平与抑郁严重程度(HAMD评分)的关系。
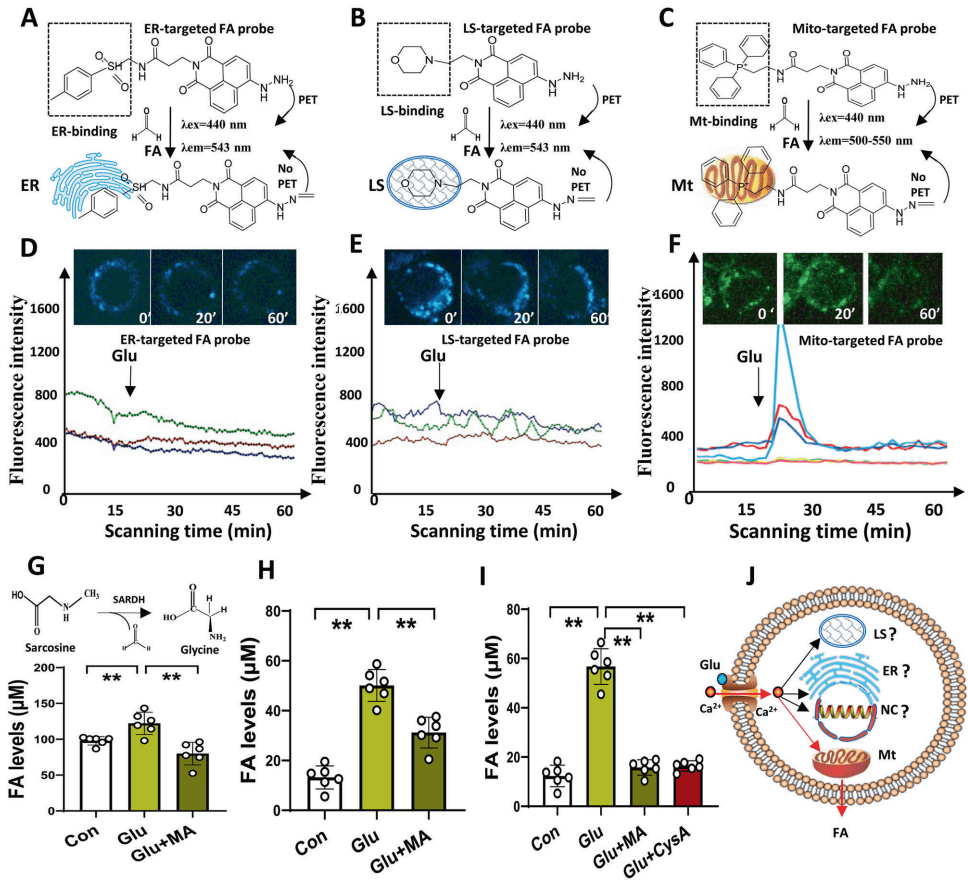
二、 核心发现:压力-FA-抑郁轴的实证证据
实验证实压力可诱导海马FA积累,并直接触发抑郁样行为与单胺耗竭。
FA的神经元来源定位:兴奋性神经递质谷氨酸(Glu)可特异性诱导线粒体FA生成,而非内质网或溶酶体。Ca2+螯合剂BAPTA和线粒体通透性转换孔抑制剂CysA可阻断此过程,证实FA生成依赖Ca2+流入和线粒体SARDH酶活性。
压力诱导FA积累:急慢性压力(尾部夹捏、电击、强迫游泳等)均导致小鼠海马CA1区FA荧光强度升高5倍。CUMS模型小鼠脑内FA生成酶(SSAO、SARDH)蛋白水平显著上调。
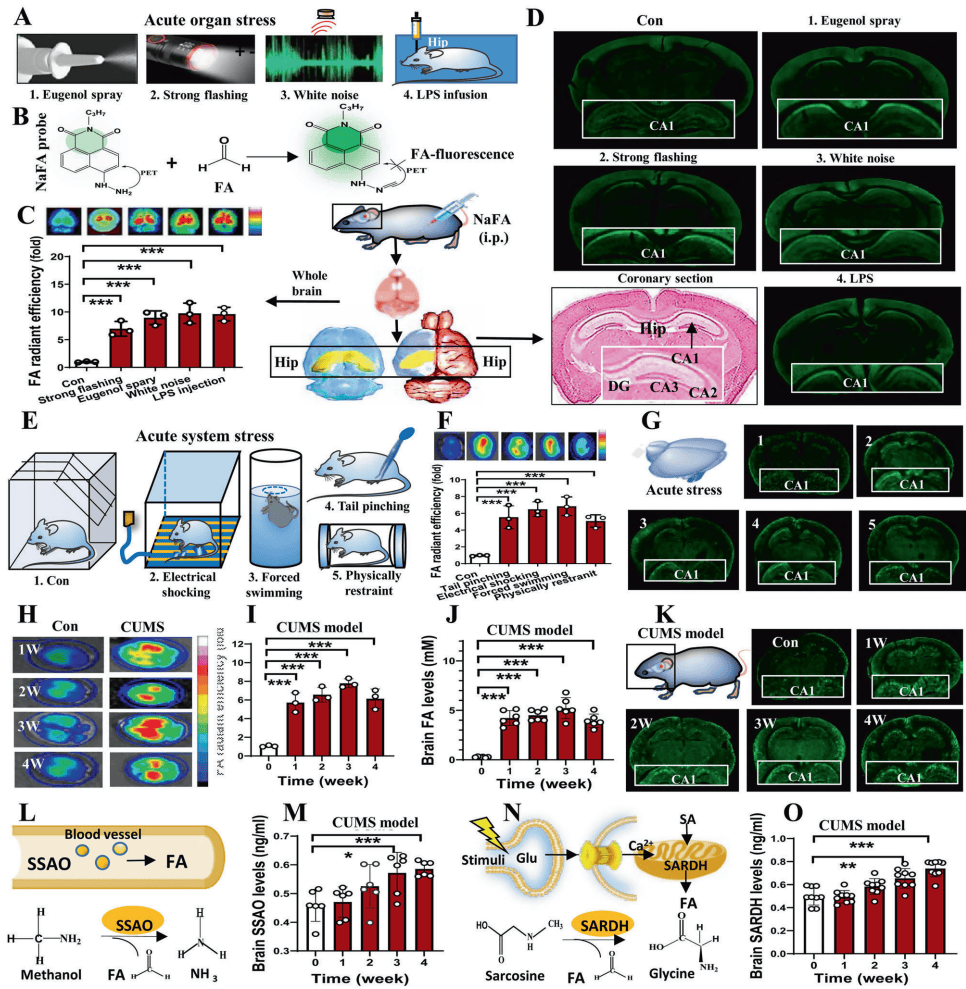
FA直接诱发抑郁行为:海马内直接注射FA(10mM,14天)诱导小鼠抑郁样行为:悬尾和强迫游泳不动时间延长,蔗糖偏好降低。FA注射组海马5-HT、DA、MT水平显著下降,且FA荧光强度与抑郁行为严重程度正相关。
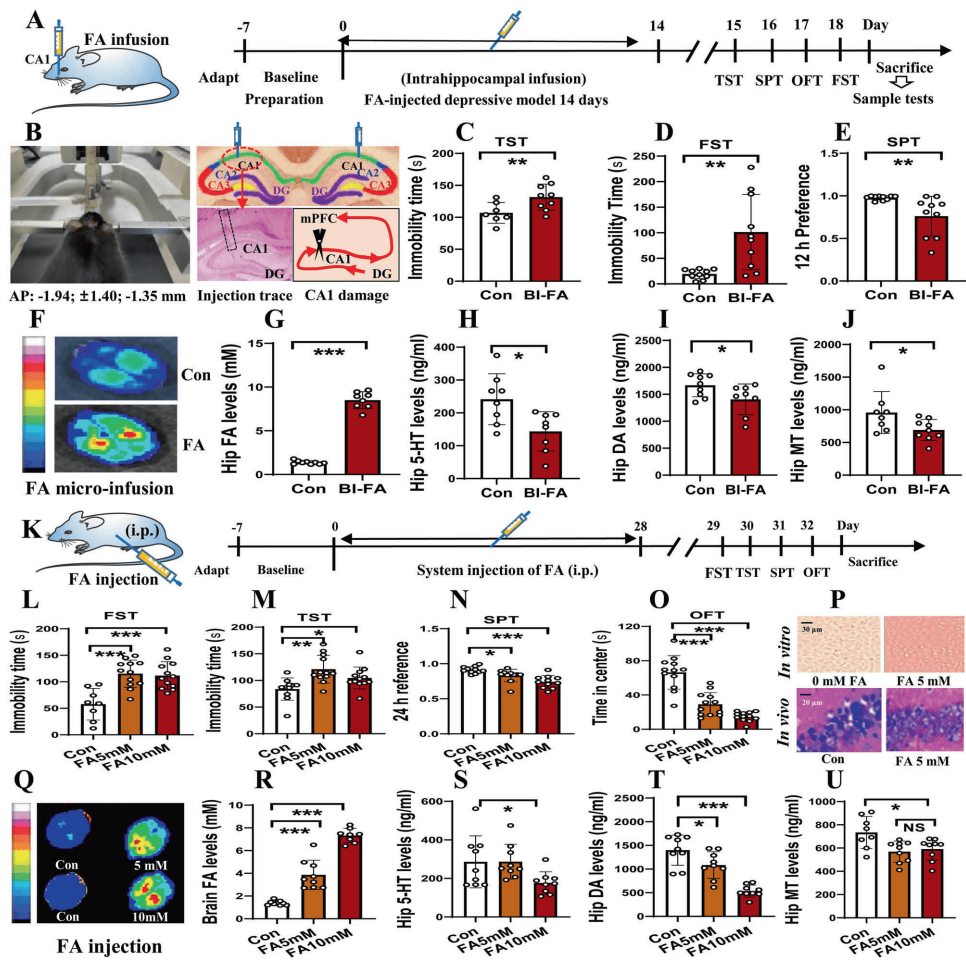
三、 机制解析:FA如何破坏神经递质平衡
FA通过共价修饰使单胺类神经递质失活,并直接抑制神经元兴奋性。
单胺类神经递质失活:体外实验显示FA与5-HT、DA、MT混合后,单胺水平显著降低。GC-MS/MS检测到FA-单胺加合物生成(5-HT加合物m/z 210.17,DA加合物m/z 171.15,MT加合物m/z 254.20),证实FA通过共价修饰使单胺失活。
神经元兴奋性抑制:脑片膜片钳记录显示,FA剂量依赖性抑制海马CA1区自发放电。5mM FA的抑制效应可洗脱逆转,而10mM FA导致不可逆损伤,提示FA毒性具有浓度依赖性。

四、 临床关联:青少年抑郁症中的FA代谢紊乱
青少年抑郁症患者显示FA代谢紊乱与海马结构损伤的临床证据,支持动物模型发现。
海马结构损伤:基于ENIGMA数据库的Meta分析显示,青少年MDD患者海马CA1区体积显著萎缩(n=73 MDD vs 72 HC),且萎缩程度与抑郁严重程度相关。
FA代谢酶失调:MDD患者(n=55)血液SSAO、SARDH活性和蛋白水平升高,FDH活性降低,导致FA积累(血清FA水平升高)和CoQ10(内源性FA清除剂)耗竭。
生物标志物价值:血液FA水平与HAMD评分正相关(r=0.68, p<0.001),而单胺水平与FA负相关,提示FA可作为抑郁症严重程度的生物标志物。

五、 现实启示:从机制到干预的新路径
FA代谢通路为抑郁症诊断和治疗提供了新的生物标志物与干预靶点。
诊断创新:血液FA水平或成为抑郁症客观诊断指标,弥补主观量表不足。
治疗新靶点:开发FA清除剂(如CoQ10类似物)或FA代谢酶调节剂,可能为抑郁症治疗提供新策略。
预防意义:减少环境FA暴露(如甲醛污染)和管理压力,可降低抑郁症发病风险。
总结
这项研究首次确立压力衍生FA作为抑郁症发病的关键触发因子,通过“压力→FA生成→单胺失活→海马损伤→抑郁行为”的完整通路,连接了环境压力与神经精神症状。未来研究应聚焦FA清除疗法的开发,以及FA作为抑郁症分层诊断和疗效预测标志物的临床转化。
睿健是脑悦康基于梁京院士团队成果的研发的脑营养补剂。其核心成分天然Smartone因子能稳定大脑抑制性受体,从根源改善睡眠与情绪,修复大脑活力,重塑日夜平衡。
文献来源:Mol Psychiatry 2025; https://doi.org/10.1038/s41380-025-03405-2
